Avances en fertilidad en la infancia y adolescencia
Avances en fertilidad en la infancia y adolescencia
M.J. Chueca Guindulain(1), C. Andrés Sesma(1), C. Eguizabal(2)
(1)Endocrinología pediátrica, Servicio de Pediatría, Complejo Hospitalario de Navarra, Pamplona. (2)Unidad de Terapia Celular y Células Madre. Centro Vasco de Transfusión y Tejidos Humanos (CVTTH). Osakidetza. Galdakao. Bizkaia.
Fecha de recepción: 23 de enero 2019
Fecha de publicación: 28 de febrero 2019
Adolescere 2019; VII (1): 48.e1-48.e15
Resumen
|
La infertilidad es uno de los efectos gonadotóxicos tras los tratamientos quimioterápicos y radioterápicos en cánceres pediátricos, y se ha convertido en una preocupación importante para pacientes y sus familias. Se han producido importantes avances en las técnicas para preservar la fertilidad ovárica, de las cuales la criopreservación de tejido ovárico es la que actualmente se considera de elección en pacientes prepuberales. Se ha realizado principalmente en pacientes con cáncer, sin embargo, se ha ido extendiendo a otras niñas con riesgo de infertilidad, como pacientes con disgenesias gonadales (síndrome de Turner) y pacientes con enfermedades reumáticas o renales sometidas a tratamientos inmunosupresores (ciclofosfamida, etc), entre otros. En varones, además de aquellos que han sufrido cáncer, existen otros con un alto riesgo de degeneración testicular, como el Síndrome de Klinefelter. La criopreservación del esperma es solo aplicable para pacientes post-puberales, por tanto es necesario tomar alternativas para pacientes pre-púberes. En la actualidad las estrategias que se contemplan son: el auto-trasplante de las células madre espermatogénicas (SSCs) expandidas in vitro, el auto-trasplante de la biopsia testicular y por último, la diferenciación in vitro de las SSCs hasta espermatozoides. En esta revisión examinamos el estado actual de los programas de preservación de fertilidad. Palabras clave: Niños prepúberes-adolescentes; Fertilidad; Criopreservación ovárica; Células madre espermatogenicas (SSCs); Biopsia testicular. |
Abstract
|
Infertility is one of the gonadotoxic side effects after chemotherapy and radiotherapy treatments in pediatric cancers, and it has become a major concern for patients and their families. Important advances in techniques for preserving ovarian fertility have taken place, of which cryopreservation of ovarian tissue is the gold standard in prepubertal patients. It has been mainly performed in patients with cancer, however, it has been extended to other girls at risk of infertility, such as patients with gonadal dysgenesis (Turner syndrome) and patients with rheumatic or renal diseases undergoing immunosuppressive treatments (such as cyclophosphamide), among others. In males, in addition to patients with cancer, there are others with a high risk of testicular degeneration, such as Klinefelter Syndrome. The cryopreservation of sperm is only applicable for post-pubertal males, therefore it is necessary to identify alternatives for pre-pubertal patients. Currently, there are several experimental strategies that are: the auto-transplant of the in vitro expanded spermatogonial stem cells (SSCs), the auto-transplant of the testicular biopsy and finally, the in vitro differentiation of the SSCs up to spermatozoa. In this review, we will examine the current status of fertility preservation programs. Key words: Prepuberal-adolescent patients; Fertility; Ovarian cryopreservation; Spermatogonial Stem Cells (SSCs), Testicular biopsy. |
Parte 1- Preservación de la fertilidad en niñas y adolescentes: criopreservación ovárica
En la actualidad, existen múltiples condiciones o patologías que pueden poner en riesgo la fertilidad de los pacientes pediátricos. De estas condiciones, el cáncer supone la causa más frecuente como consecuencia de los tratamientos de quimioterapia, radioterapia y cirugía que se utilizan
Existen diversos tipos de pacientes que por su condición personal (problemas endocrinológicos, genéticos, así como enfermedades benignas del ovario con riesgo del fallo ovárico prematuro) o por el tratamiento al que van a ser sometidas (tratamientos antineoplásicos con radioterapia y/o quimioterapia, inmunosupresores como la ciclofosfamida en enfermedades reumáticas, etc.) pueden ver comprometida su fertilidad, entendida como la capacidad reproductiva de una persona, es decir, la posibilidad de quedar embarazada en el caso de mujeres o la capacidad de procrear en los hombres.
La pérdida de la fertilidad puede tener importantes consecuencias sobre la calidad de vida de los niños o de los adolescentes en riesgo. En el momento actual existen diversas técnicas encaminadas a preservar la fertilidad en mujeres. Desde hace años está disponible la criopreservación de embriones para mujeres adultas y jóvenes con pareja y la de ovocitos en jóvenes postpuberales, pero ambas precisan de la estimulación ovárica para la recogida de los ovocitos; en el caso de pacientes afectas de cáncer esto supondría un retraso del inicio del tratamiento, el cual, en la mayoría de las ocasiones, no se puede asumir. También deberemos valorar las cuestiones éticas presentes y futuras que estas técnicas plantean y las creencias religiosas del paciente y su familia a la hora de realizar el consentimiento informado adecuadamente. En pediatría, estas técnicas no pueden utilizarse ya que las pacientes, niñas y adolescentes puberales, no tienen el ovario suficientemente desarrollado para producir ovocitos maduros. Existe la posibilidad de la criopreservación de tejido ovárico, que aun siendo experimental, es la técnica de elección en pacientes prepúberes, dado que es segura, con pocos riesgos y comienza a cosechar buenos resultados.
Han ido surgiendo técnicas para preservar la fertilidad en niñas, de las cuales la criopreservación de tejido ovárico es de elección en edad pediátrica, siendo una técnica experimental pero segura, con pocos riesgos y con resultados prometedores
Como profesionales sanitarios será imprescindible conocer la magnitud del problema de estas pacientes para abordarlo, individualizando y valorando el riesgo de cada una de ellas, entendiendo la fisiología de la fertilidad y cómo puede afectar cada agente externo según las peculiaridades del mismo y las características de la paciente.
Además en aquellas pacientes con riesgo de pérdida de su fertilidad que hayan sido sometidas a técnicas de preservación de la misma, será fundamental realizar un seguimiento adecuado de la fertilidad a través de niveles hormonales (hormona antiMülleriana) y recuento ecográfico de folículos ováricos.
Fisiología de la fertilidad y consecuencias de alteración de la misma
Definimos la fertilidad como la capacidad reproductiva de un individuo, la cual a su vez depende del correcto funcionamiento de diversos factores.
a) Eje hipotálamo-hipófisis-ovario
Este eje hormonal tiene distintas funciones como son la maduración de los ovocitos y del revestimiento uterino, es responsable de la ovulación y pone en marcha la pubertad y los caracteres sexuales secundarios.
En caso de alterarse el eje hormonal del ovario, se podrán objetivar alteraciones en el desarrollo puberal o alteraciones menstruales.
En relación a alteraciones del desarrollo puberal podremos objetivar un retraso de la pubertad (cuando una niña a la edad de 13 años no presenta signos externos de desarrollo mamario) o una pubertad detenida o incompleta (cuando una niña tras comenzar una pubertad espontánea, deja de progresar y queda estancada) siendo en ambos casos la causa más frecuente la aparición de un hipogonadismo hipogonadotropo o hipergonadotropo que requerirá tratamiento hormonal sustitutivo con estrógenos y progestágenos; también podremos objetivar alteraciones en el desarrollo puberal en forma de pubertad precoz (cuando una niña comienza desarrollo puberal antes de los 8 años), como consecuencia de una activación precoz del factor liberador de FSH y LH por agentes externos, siendo necesario en este caso un tratamiento con análogos de LHRH para evitar consecuencias a nivel del desarrollo de caracteres sexuales pero también a nivel del pronóstico de talla.
Respecto a las alteraciones menstruales, podrán aparecer amenorreas primarias o secundarias, según si la alteracion del eje gonadal ocurre antes o tras la menarquia.
b) Estado uterino
Cuando el estado uterino es adecuado se favorece la implantación embrionaria y el desarrollo del feto. Por el contrario, si la anatomía o estructura del útero se ve alterada o modificada, puede conllevar abortos espontáneos, prematuridad o niños pequeños para la edad gestacional.
c) Células de la línea germinal
Cuando nace una mujer existe una reserva de 1 o 2 millones de folículos primordiales en profase diplotene de la primera división meiótica. Tras la menarquia y con cada menstruación a través de la hormona FSH, una cantidad de folículos primordiales es movilizado y madurado pasando a folículos antrales productores de inhibina B o estradiol que producen crecimiento de los folículos y desarrollo endometrial. De todos los folículos antrales solo uno, llamado folículo dominante, llegará como óvulo a las trompas de Falopio con la ayuda de la hormona LH y este en caso de no ser fecundado por un espermatozoide se desprende en forma de menstruación. El resto de folículos antrales no desprendidos se reabsorben.
El ovario tiene un papel hormonal, además de ser el órgano encargado de la fertilidad, en cuanto a la producción de gametos femeninos se refiere. Por tanto, cualquier lesión existente en el ovario puede provocar alteraciones hormonales, alteraciones en la fertilidad, alteraciones en el desarrollo puberal o alteraciones menstruales.
Ante una lesión ovárica podremos objetivar las siguientes consecuencias:
Cualquier agente externo que afecte al eje hormonal del ovario, útero o células germinales pueden comprometer la fertilidad
- Fallo ovárico precoz agudo: cuando se alteran ambas funciones gonadales (tanto la hormonal como la reproductiva); ocurriendo escasos meses tras la exposición al agente externo que lo ocasionó pero siempre antes de los 5 años de dicha exposición. Al alterarse ambas funciones ováricas se objetivarán cifras altas de FSH superiores a 25 IU/l, asociadas a niveles bajos de estradiol y una amenorrea igual o superior a 4 meses, lo que facilitará el diagnóstico de fallo ovárico precoz. Estas pacientes precisarán tratamiento hormonal sustitutivo con estrógenos y progestágenos para solucionar el problema hormonal, así como técnicas de preservación de la fertilidad, que deberían haberse llevado a cabo antes de la exposición al agente externo que ocasionó el problema (por ejemplo un tratamiento antineoplásico).
- Menopausia prematura: el fallo ovárico ocurre antes de los 40 años de edad pero más allá de los 5 años tras la exposición al agente externo que ocasiono la alteración ovárica.
Con todo lo anterior descrito, se deduce que cualquier agente externo (cirugía, radioterapia, quimioterapia, disgenesia gonadal ovárica, etc.) que afecte al eje hormonal del ovario, al útero o a las células germinales, puede comprometer la fertilidad.
Técnicas de preservación de la fertilidad ovárica en pediatría
Actualmente, los procedimientos disponibles para la preservación de la fertilidad ovárica son:
a) Técnicas preventivas:
- Quimioprofilaxis mediante utilización de Gn-RH.
- Trasposición ovárica fuera del área a irradiar por radioterapia.
b) Criopreservación de embriones.
c) Criopreservación de ovocitos.
d) Criopreservación de tejido ovárico.
Cada técnica tiene sus peculiaridades, indicaciones y contraindicaciones que se describen a continuación.
a) Quimioprofilaxis utilizando análogos Gn-RH
Se ha utilizado durante décadas, con la idea teórica de crear en la paciente un estado hipogonadotropo similar al prepuberal, momento de la vida en el cual, los efectos gonadotóxicos de tratamientos de quimioterapia o inmunosupresores son menores con respecto a la etapa puberal y postpuberal. Existen estudios en animales en los que se ha objetivado un efecto protector de los análogos Gn-RH en la disminución de folículos ováricos tras estos tratamientos y otros sin embargo, han concluido con resultados contradictorios.
Meta-análisis realizados hasta el momento han mostrado que este tratamiento puede restaurar mejor el ciclo menstrual tras el tratamiento del cáncer, pero probablemente no reduce la gonadotoxicidad de los tratamientos, al no mejorar las tasas de embarazo y el potencial de fertilidad con ovulaciones espontáneas(1).
La ASCO sugiere que el cotratamiento con análogos de Gn-RH pueda tener algún beneficio, como la reducción del sangrado vaginal en pacientes bajas de plaquetas por la quimioterapia, pero no hay suficiente evidencia para recomendarlo como un método para preservar la fertilidad.
Por tanto, en el momento actual, la utilización de análogos Gn-RH como técnica de preservación de la fertilidad ovárica no debería ser recomendada como primera opción.
b) Trasposición ovárica fuera del área a irradiar por radioterapia
En pacientes con cáncer, la radiosensibilidad alta de los ovocitos hace que la radiación ovárica pueda llegar a ser mucho más dañina para el tejido ovárico que la quimioterapia. En aquellas niñas o adolescentes afectas de cáncer que vayan a ser sometidas a radioterapia pélvica (sin quimioterapia) como tratamiento de su enfermedad, podrían beneficiarse de la trasposición ovárica, retirando los ovarios del área irradiada con la ventaja de que si los ovarios traspuestos se reubican en una zona abdominal, podría esperarse un embarazo espontáneo. Sin embargo, hoy en día las tasas de éxito de este procedimiento no son del todo consistentes, por la posible dispersión de la radiación y permanece como un método experimental.
c) Criopreservación de embriones
La criopreservación de embriones cuenta con una ventaja importante y es que se trata de una técnica con una eficacia ya demostrada. Sin embargo, en edad pediátrica tiene diversas consideraciones que hacen inviable su indicación:
- La paciente debe estar en edad fértil para poder llevarse a cabo.
- Necesita de una estimulación ovárica para extraer los ovocitos.
- Necesita de semen de la pareja o de un donante anónimo que fecunde los ovocitos extraídos.
- No está exento de consideraciones sociales, éticas y/o religiosas, tras la creación y almacenaje de embriones humanos.
d) Criopreservación de ovocitos
La criopreservación de ovocitos se considera la técnica de elección en edad fértil, pero necesita estimulación ovárica para extraer los ovocitos
Se le considera la técnica de elección en pacientes en edad fértil. Presenta diversas ventajas como:
- Es una técnica con eficacia ya demostrada, que ya no se considera experimental, bastante fácil de realizar y con buenos resultados.
- No precisa tener una pareja para su realización.
- Se evitan las consideraciones sociales, éticas o religiosas que plantea la criopreservacion de embriones, dado que éstos no se generan.
Sin embargo, también presenta desventajas, entre las que se destacan:
- La paciente debe estar en edad fértil para llevarse a cabo.
- Necesita también de una estimulación ovárica para extraer los ovocitos.
Al hablar de pacientes pediátricas, es entendible que las desventajas de ambas técnicas son importantes y como consecuencia dificultan o imposibilitan el procedimiento, puesto que la paciente en el momento en el que se encuentre en riesgo su fertilidad puede no tener todavía una edad postpuberal, ni pareja estable. Además este procedimiento no se puede realizar en pacientes que precisan iniciar la quimioterapia con urgencia ya que requiere unos 10-15 días para estimular la ovulación y recoger los ovocitos, previo a su criopreservación.
Se ha reportado una tasa de nacimiento alrededor de 5.7% por ovocito vitrificado, lo que supone que sean necesarios unos 10 ovocitos para que una mujer tenga una posibilidad real de embarazo(2).
e) Criopreservación de tejido ovárico
La criopreservación de tejido ovárico es la técnica de elección y única alternativa de preservar la fertilidad ovárica en prepúberes o adolescentes
Actualmente, es la técnicade elección y única alternativa de preservar la fertilidad ovárica en pacientes prepúberes, así como la más utilizada en pacientes adolescentes.
Esta técnica presenta diversas ventajas respecto a la criopreservación de embriones u ovocitos:
- No precisa de estimulación ovárica y no influye en la actitud terapéutica.
- No es preciso que la paciente tenga pareja para su realización.
- Se puede combinar con cualquiera de las otras técnicas previas, lo que mejora las posibilidades de preservar la fertilidad.
- No plantea tantos dilemas éticos como la criopreservación embrionaria.
- Tras la utilización del trasplante de tejido ovárico, en caso de ser preciso, es posible que se restablezcan ambas funciones del ovario, tanto la hormonal, como la reproductiva y que incluso se consiga un embarazo por métodos naturales.
Sin embargo, la técnica también presenta algunas desventajas, como son:
- La forma de recoger el tejido ovárico para su preservación se realiza mediante cirugía, lo que supone un método invasivo para la paciente.
- En el caso de las pacientes con cáncer, existe la posibilidad de reinsertar células cancerígenas malignas tras la utilización del tejido ovárico criopreservado.
- Todavía se considera una técnica experimental, principalmente por la escasez de datos publicados sobre la efectividad de la técnica, ya que mayoritariamente se publican los casos de éxitos de embarazos y no los fracasos.
El proceso por el cual se lleva a cabo la criopreservación de tejido ovárico, se realiza en diversos pasos:
- Selección de las pacientes candidatas a la criopreservación ovárica, según el riesgo derivado de su enfermedad y su tratamiento, informando adecuadamente a las pacientes y/o padres o tutores legales y obteniendo el pertinente consentimiento informado. Para la selección de las pacientes, se tendrán en cuenta aspectos como:
- Edad de la paciente: las edades máximas o mínimas para llevar a cabo la técnica de criopreservación ovárica no están bien establecidas y los datos disponibles en pacientes menores de 5 años son escasos y por tanto la indicación de la técnica en estas niñas deberá ser siempre estudiada de forma más exhaustiva.
- Riesgo intermedio o alto de gonadotoxicidad.
- Situación clínica respecto a la enfermedad de base (cáncer, autoinmunidad, etc.).
- Esperanza de vida adecuada en relación a su enfermedad.
- Descartar posibles complicaciones prevenibles respecto al acto quirúrgico que conlleva la recogida de tejido ovárico para criopreservar.
- Recogida del tejido ovárico a criopreservar, que suele realizarse mediante laparoscopia y con anestesia general, de tal forma que se realizan múltiples biopsias (generalmente en pacientes puberales) u ooforectomía parcial o total (habitualmente en pacientes prepuberales). En el caso de pacientes con cáncer o pacientes sometidas a tratamientos que comprometan la fertilidad, la recogida del tejido a congelar, se realizará previamente al inicio del tratamiento prescrito. Es importante destacar que no es necesaria la realización de una estimulación ovárica previa recogida de material ovárico, lo cual hace que no se interfiera en el inicio del tratamiento de la paciente.
- Una vez recogido el tejido ovárico, se divide en fragmentos con tamaños que oscilan entre 1-10 mm para garantizar la presencia de folículos primordiales, teniendo en cuenta además que el espesor de los fragmentos sea en torno a 1-2 mm para asegurar que la criopreservación sea adecuada garantizando una buena difusión de la solución crioprotectora.
- Congelación del tejido ovárico obtenido. Existen diversos métodos para llevar a cabo la congelación de los fragmentos ováricos; la congelación rápida o ultrarrápida y la lenta, siendo esta última la de elección actualmente. La congelación lenta consiste en reducir la temperatura 0.3ºC por minuto hasta alcanzar los -196ºC y entonces introducir el material ovárico en nitrógeno líquido.
- Descongelación o desvitrificación del tejido ovárico criopreservado, cuando sea necesaria la utilización del mismo. Cuando la congelación se ha llevado a cabo de forma lenta, la descongelación requerirá de una fase de calentamiento lento que consiste en descongelación ambiental durante
1 minuto y posteriormente introducción en un baño a 37ºC. - Implantación en la paciente tras la descongelación y retirada de la solución crioprotectora. Las localizaciones de implantación del tejido ovárico criopreservado pueden ser:
- En localización ovárica o anatómica (implantación ortotópica) lo cual genera una ventaja indudable y es la posibilidad de embarazo espontáneo.
- En localización no habitual como puede ser en zona subcutánea o intramuscular (implantación heterotópica).
- Una vez trasplantado el tejido ovárico se espera conseguir una revascularización del tejido implantado y posterior inicio de la actividad del ovario que podrá mantenerse aproximadamente 4-5 años, vida media estimada del trasplante; no obstante, si es preciso podría repetirse el proceso de ser necesario. Es importante recordar que con la utilización del tejido ovárico criopreservado en pacientes con cáncer, existe riesgo de reintroducir células cancerígenas y por tanto, en estos casos dicho tejido ovárico criopreservado no podrá ser autotrasplantado hasta que se haya descartado la presencia de células tumorales con un estudio anatomo-patológico adecuado.
Se han publicado recientemente resultados de criopreservación ovárica como método de preservación de fertilidad, con tasas de nacimientos entre el 23 y el 37%(3). Desafortunadamente el tejido ovárico trasplantado parece sufrir un hiperreclutamiento inicial de folículos con una foliculogénesis disfuncional que determina una alteración de la reserva de folículos en el tejido trasplantado, llegando incluso al 50% de pérdida por isquemia y daño por el stress oxidativo tisular.
Perspectivas futuras
La maduración in vitro de los folículos inmaduros recogidos del tejido ovárico en la criopreservación(4), aunque todavía en investigación, podría ser una opción posible para pacientes con cáncer y riesgo de reintroducir células malignas en la reimplantación ovárica. La técnica consiste en aspirar folículos inmaduros (preantrales/antrales) del tejido ovárico recogido e incubarlos en un medio de maduración, con la vitrificación posterior de los ovocitos maduros.
La creación de un ovario artificial, es una técnica prometedora para crear un microambiente óptimo para el desarrollo de folículos y células ováricas
La creación de un ovario artificial es otra técnica prometedora con el objetivo de reducir la posibilidad de diseminar células malignas, creando un microambiente óptimo para el desarrollo y crecimiento de folículos aislados y células ováricas.
Seguimiento de la fertilidad y de la función ovárica tras la preservación de la fertilidad
Cuando se ha preservado la fertilidad de una paciente es necesario realizar un seguimiento ambulatorio de la fertilidad y de la función ovárica para objetivar la evolución de la reserva ovárica estimada, solucionar problemas que puedan surgir respecto a alteraciones en la función ovárica hormonal o incluso optimizar la fertilidad combinando técnicas si es posible y si se estima una reserva ovárica folicular baja o en descenso(5).
Se deberá realizar un seguimiento con una adecuada anamnesis, exploración, determinaciones hormonales y ecografía ovárica
El seguimiento de estas pacientes se llevará a cabo a través de una adecuada anamnesis y exploración física y mediante la determinación de niveles hormonales de gonadotropinas, estradiol y hormona antiMülleriana así como a través del recuento de folículos ováricos a través de ecografía.
1. Ecografía uterina y ovárica
La ecografía permite objetivar la anatomía del útero pero también la forma, tamaño, estructura y número de folículos ováricos. Puede llevarse a cabo de forma abdominal o transvaginal según las características de la paciente (edad, madurez psicológica, etc.).
Respecto al número de folículos ováricos, destacar que se ha estimado que una mujer sana y adulta, con una edad entre los 25 y los 34 años, posee unos 15 folículos antrales que van disminuyendo de forma natural y progresiva con la edad. Un menor número de folículos ováricos de lo que cabría esperar para la edad de la paciente, puede indicarnos una menor reserva ovárica.
2. Determinación de niveles hormonales
Se valorará el eje hormonal del ovario a través de niveles basales de gonadotropinas (FSH y LH), así como de estradiol y de forma ocasional con pruebas de estimulación ovárica (test de estimulación de GnRH o análogos de GnRH).
Por otra parte, resulta imprescindible la determinación de hormona antiMülleriana, cuyos niveles plasmáticos se han relacionado con la reserva ovárica. Aunque no existen valores de referencia estandarizados, por lo general, son considerados normales los niveles de hormona antiMülleriana entre 0,7 y 4 ng/ml y los valores por debajo de 0,7 ng/ml pueden indicar una reserva ovárica baja. Según la literatura actual a menores niveles plasmáticos de hormona antiMülleriana, podemos entender menor reserva ovárica, pero todavía no queda claro si puede utilizarse como marcador de potencial reproductivo.
Con un adecuado seguimiento de las pacientes, va a ser posible detectar y solucionar los problemas que puedan acontecer, tanto en la función hormonal como en la reserva folicular ovárica. La combinación de niveles de hormona antiMülleriana y el recuento ecográfico de folículos ováricos permiten realizar una estimación de la reserva ovárica y que a menor número de ambos la reserva ovárica estimada es más baja.
Indicaciones más frecuentes para preservar la fertilidad ovárica en pediatría
- Pacientes afectas de cáncer
En la actualidad, a través de la utilización de tratamientos de radioterapia y quimioterapia, las tasas de curación del cáncer en niños y adolescentes se sitúan en torno al 80%. Sin embargo estos tratamientos pueden afectar a la fertilidad de las pacientes, siendo la infertilidad la endocrinopatía más frecuente. La quimioterapia tiene un efecto gonadotóxico por afectación de folículos ováricos que conforman la reserva folicular ovárica provocando su disminución. De todos los agentes quimioterápicos, los agentes alquilantes (ciclofosfamida) son los más peligrosos. Respecto a la radioterapia, puede ser incluso más perjudicial que la quimioterapia, dado que los ovocitos son muy radiosensibles pudiendo también disminuir el número de folículos ováricos, pero además según el área irradiada puede afectarse el área hipotalámica-hipofisaria o el útero.
Existen diversos factores que influyen en el riesgo potencial de alteración de la fertilidad en las pacientes con cáncer, como la edad del debut de la enfermedad, el tipo de enfermedad y el tipo de tratamiento a las que van a someterse (quimioterapia, radioterapia y/o cirugía)(6). En relación a la edad al diagnóstico, el riesgo de infertilidad es mayor cuanto mayor sea la edad de la paciente, dado que la gonadotoxicidad de la quimioterapia y la radiosensibilidad de los ovocitos a la radioterapia aumentan. Respecto al riesgo de infertilidad en relación al tipo de enfermedad y tipo de tratamiento quimioterápico, se refleja en la Tabla II.
Es preciso identificar a aquellas/os pacientes con riesgo de infertilidad y realizar un abordaje individual para buscar soluciones
Como se deduce de todo lo expuesto, cada paciente tendrá un riesgo potencial de ver alterada su fertilidad, siendo necesario un abordaje individualizado de cada paciente y seleccionando a las pacientes para preservar su fertilidad según su riesgo(7). En la actualidad, suelen seleccionarse a aquellas pacientes con riesgo alto o intermedio de ver alterada su fertilidad en relación a su neoplasia, sin embargo, cada vez más se postula la idea de valorar preservar la fertilidad de todas las pacientes, dado que el riesgo de infertilidad puede variar durante el transcurso de la neoplasia y en caso de alcanzarse en algún momento una situación de alto riesgo, la paciente habrá estado expuesta a tratamiento gonadotóxico que ha podido influir de alguna manera sobre el propio ovario.
- Pacientes con necesidad de tratamiento quimioterápico en relación a causas no tumorales
Nos referimos a pacientes con enfermedades hematológicas que pueden precisar tratamiento quimioterápico con ciclofofamida previo al trasplante de progenitores hematopoyéticos como acondicionamiento al mismo (talasemia, anemia falciforme, síndrome de Wiskott-Aldrich, etc.), pacientes con enfermedades autoinmunes (lupus eritematoso sistémico, etc.) o enfermedades renales (síndrome nefrótico, etc.) donde agentes como la ciclosfosfamida podrían ser utilizados como inmunosupresores(8,9).
En estas pacientes, se valorará e individualizará el riesgo de pérdida de fertilidad por gonadotoxicidad igual que en las pacientes con cáncer.
- Pacientes con alteraciones de la diferenciación sexual
Incluimos en este grupo principalmente a pacientes con disgenesias gonadales y síndrome de Turner, siendo este último una de las causas genéticas que pueden provocar disminución de la reserva folicular ovárica. Por otra parte como es bien conocido, en el síndrome de Turner existen pacientes con dotación genética 45X0 las cuales presentan un riesgo de infertilidad total muy alto, por tanto no van a poder beneficiarse de técnicas de preservación; sin embargo, también existen pacientes con una dotación genética tipo mosaico 46XX/45X0 las cuales pueden presentar desarrollo puberal y menarquia, estando incluso descritos casos de embarazos espontáneos. Es por esto que algunas pacientes con dotación genética mosaico no presentan una infertilidad total pero sí riesgo de la misma, por lo que podrían beneficiarse de técnicas de preservación de la fertilidad antes de ver afectada toda su reserva ovárica.
- Pacientes con disforia de género
En la actualidad, en aquellas niñas y adolescentes con disforia de género que inician tratamientos bloqueantes de la pubertad con análogos GnRH y posteriormente tratamiento hormonal cruzado, es deseable que en las consultas se aborde y se discuta el tema de la fertilidad. Raramente se podrá indicar la criopreservación de tejido ovárico ya que el ovario es inmaduro (al no estar expuesto al influjo hormonal de la pubertad femenina) y por tanto en el momento del trasplante precisaría hormonas femeninas para su desarrollo, siendo necesario una reversión del tratamiento hormonal en la persona transexual, situación poco probable si persiste la transexualidad.
Parte 2- Programa de preservación de la fertilidad en niños prepúberes. Estado actual y aplicaciones en oncología y endocrinología pediátrica
Por el momento, la única técnica efectiva y rutinaria en nuestros hospitales sobre preservación de la fertilidad en varones, es la preservación de esperma. Sin embargo, en pacientes prepúberes con diagnóstico de una patología con alto riesgo de degeneración testicular es recomendable preservar su fertilidad. Debido a su inmadurez en el tejido testicular no pueden producir esperma y por tanto es recomendable criopreservar una biopsia testicular
El cáncer es una causa importante de mortalidad en niños y adolescentes. Sin embargo, como resultado de las notables mejoras en los tratamientos, las tasas de mortalidad por cáncer en la infancia y la adolescencia han sufrido una importante disminución. Los resultados de los datos europeos y estadounidenses sugieren que se puede esperar una supervivencia del 80% de los niños y adolescentes diagnosticados con cáncer. Desafortunadamente, los tratamientos utilizados para curar el cáncer, como la quimioterapia y la radioterapia, debido a su exposición, dosis y a su efecto gonadotóxico, pueden dañar a las células madre espermatogénicas (SSCs) en los testículos de estos pacientes, teniendo problemas de infertilidad a largo plazo, en la mayoría de los casos permanentes(10). Además de estas enfermedades malignas, hay otro tipo de síndromes genéticos, como el Síndrome de Klinefelter que puede conducir a la pérdida prematura de células madre de la línea germinal en niños(11).
Se han desarrollado diferentes estrategias para salvaguardar la fertilidad de estos jóvenes pacientes, en primer lugar la criopreservación de espermatozoides, como tratamiento de preservación de la fertilidad de primera línea, en el caso de pacientes adolescentes, realizándose de forma rutinaria(10). Sin embargo, para algunos adolescentes y claramente para varones prepúberes esta opción no es posible. Para ambos, la criopreservación de tejido testicular es la única alternativa experimental que existe para preservar su fertilidad.
En este artículo revisaremos el estado del arte sobre los programas de preservación de fertilidad en niños prepúberes y las estrategias para restaurar la fertilidad en estos pacientes en un futuro.
Criterios de selección de pacientes con riesgo gonadotóxico o degeneración testicular que podrían beneficiarse de programas de preservación de la fertilidad
Los efectos adversos de las terapias antitumorales en los órganos reproductivos son el resultado de daños a nivel del eje hipotalámico-pituitario-gonadal, o a nivel de las células madre espermatogénicas (SSCs) en las gónadas debido a la quimioterapia y la radioterapia. En los varones, la espermatogénesis es altamente sensible a los efectos dañinos de los agentes alquilantes, siendo los diagnósticos de oligozoospermia o azoospermia comunes en pacientes con cáncer(12). En la Tabla II se resumen los principales riesgos estimados de infertilidad según los agentes quimioterápicos y radioterapia utilizados en tratamientos contra el cáncer(10,13). Es importante destacar que la combinación de agentes, la frecuencia y duración de su administración son factores clave para la determinación de los efectos gonadotóxicos. No obstante, se consideran a los pacientes con tratamiento de riesgo alto gonadotóxico, los que en un futuro desarrollarán problemas de fertilidad en un porcentaje muy alto.
En el caso de los pacientes con Síndrome de Klinefelter, durante la pubertad, los testículos no se desarrollan correctamente en la mayoría de los casos. Debido al exceso de gonadotropina se produce de forma progresiva una hialinización y fibrosis de los túbulos seminíferos, con una inadecuada producción de testosterona produciendo una azoospermia en la mayoría de casos, requiriendo por ello tratamiento con testosterona a largo plazo.
Por consiguiente, como medida de prevención, es aconsejable la congelación de esperma o tejido testicular a todos los pacientes que vayan a ser sometidos a tratamientos potencialmente gonadotóxicos o que exista un riesgo de degeneración testicular. La Tabla III resume las principales patológicas tumorales, no tumorales y otros casos que están indicadas para que estos pacientes se beneficien de programas de preservación de fertilidad.
Criopreservación de esperma en niños y adolescentes
La obtención y criopreservación de esperma es la única técnica clínica disponible y validada actualmente para salvaguardar la fertilidad futura de niños y adolescentes peripúberes. Criopreservar esperma debe ofrecerse siempre como tratamiento de primera línea en aquellos pacientes jóvenes que se pueda obtener esperma en eyaculado, búsqueda de esperma en orina o mediante técnicas como electroestimulación o vibroestimulación. Como se ha comentado anteriormente, se aconseja preservar esperma en los pacientes con las siguientes patologías con alto riesgo de infertilidad, como se muestran en la Tabla III.
Criopreservación de tejido testicular inmaduro en niños y adolescentes prepúberes
Gracias a años de investigación en este ámbito, se ha podido abordar con diferentes estrategias el poder restablecer la espermatogénesis completa a partir de una biopsia criopreservada, primero validándose su eficacia y seguridad en modelos animales y ahora estamos a la espera en humanos
En los casos en que no se pueda recoger esperma, está indicado la criopreservación de tejido testicular inmaduro donde residen las células madre espermatogénicas (SSCs). En la actualidad es una técnica experimental en humanos.
Para minimizar el daño al paciente, la recogida de la biopsia testicular debe de combinarse con otras intervenciones que requieran anestesia, como la colocación del reservorio para la quimioterapia, en el caso de los pacientes oncológicos.
Los protocolos de congelación para tejido testicular inmaduro humano que se han descrito, usan agentes crioprotectores que van desde 1,5 M de etilenglicol y sacarosa a 0.7M DMSO y sacarosa o únicamente DMSO 0.7 M, siendo este último el más usado. El método de congelación puede ser mediante congelación lenta (congeladores programables o en recipientes con isopropanol a -80Cº) o por vitrificación.
De hecho, la evaluación del tejido testicular inmaduro humano después del xenotrasplante en ratones sugiere que la vitrificación puede ser tan efectiva para la preservación de tejidos como métodos de congelación lenta. Es muy importante que todos los procesos desde la recogida, el procesamiento, la congelación y la descongelación sean protocolos optimizados para garantizar la viabilidad del tejido testicular inmaduro criopreservado.
Estrategias para la restauración de la fertilidad utilizando tejido testicular y sus SSCs criopreservadas
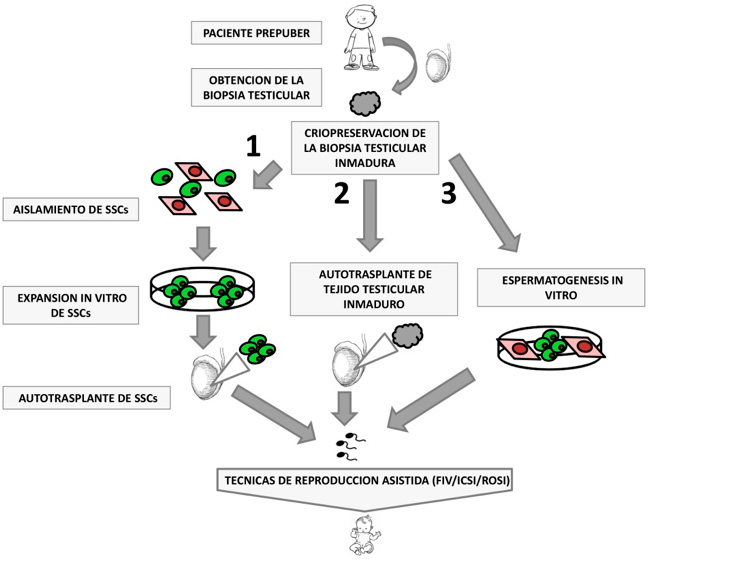
Como se ha comentado anteriormente una vez criopreservada la biopsia testicular y que el paciente en un futuro tenga problemas de fertilidad, se plantea entonces el momento de restablecer su fertilidad. En la actualidad existen tres estrategias(13): expansión in vitro y autotrasplante de las SSCs; autotrasplante de la biopsia testicular y espermatogénesis in vitro como se indican ambas tres en la Figura 2.
Todas estas estrategias han sido validadas en modelos animales (ratón, rata, primate no humano) obteniendo descendencia fértil y sana, pero aún no se ha realizado la primera restauración de la fertilidad en humanos. Es cierto que estos programas de fertilidad son pioneros en otros países Europeos y por consiguiente parece una cuestión de tiempo en que se realicen los primeros autotrasplantes en varones adultos humanos demostrándose por tanto su seguridad y efectividad para su uso clínico.
1. Aislamiento, expansión in vitro y autotrasplante de SSCs.
Algunos países europeos pioneros en este tipo de programas, llevan más de 15 años criopreservando biopsias testiculares prepuberales y lógicamente a corto plazo se iniciarán los primero autotrasplantes de biopsias testiculares en pacientes con problemas de fertilidad
Actualmente, el autotrasplante de SSCs se considerada la herramienta más prometedora para restaurar la fertilidad en pacientes con cáncer prepúberes y en pacientes con Síndrome de Klinefelter. Esta técnica fue originalmente descrita en el ratón en 1994 por Brinster y Zimmermann. Se ha infundido con éxito SSCs expandidas previamente in vitro a través del conducto eferente en el testículo, restableciendo la espermatogénesis en modelos murinos. Sin embargo, debido a las diferencias en la anatomía y el tamaño testicular, el trasplante de SSCs a través de la rete testis se ha demostrado ser mejor lugar para especies como la bovina, primate y humana. Esta técnica se ha aplicado en varios modelos animales, incluidos primates no humanos, con resultados exitosos y produciendo espermatozoides capaces de fecundar oocitos, incluso con tejido criopreservado durante años. Sin embargo, a pesar de los buenos resultados obtenidos en modelos animales, existen problemas importantes que hay que resolver antes de la aplicación en humanos.
En esta técnica en primer lugar es necesario, aislar y propagar in vitro las SSCs antes del autotrasplante para obtener el número óptimo y necesario para recolonizar eficientemente el testículo(14,15).
Se ha descrito en modelos murinos que solo el 5-10% de las SSCs trasplantadas dan como resultado la formación de colonias en el testículo receptor y por tanto la restauración de la espermatogénesis in vivo está directamente relacionada con el número de células SSCs trasplantadas. Además, estudios en ratón han indicado que los factores como el factor neurotrófico derivado de la línea celular glial (GDNF), que facilita auto-renovación de las SSC, es esencial para la propagación de las SSCs. Es importante destacar que en el contexto de la restauración de la fertilidad humana, tanto en adultos como en prepúberes, se han cultivado con éxito SSCs in vitro sin perder su capacidad de ser células madre o capacidad para colonizar los túbulos seminíferos en un xenotrasplante de varias especies. Asimismo, teniendo en cuenta que alrededor del 21% de los cánceres hematológicos pueden presentar infiltración testicular de células malignas, existe el riesgo de reintroducirlas en futuros autotrasplantes de SSCs. Por lo tanto, la propagación in vitro de SSC puede ser una estrategia útil para enriquecerlas al mismo tiempo que elimina la presencia de células tumorales contaminantes que podrían estar presentes en la biopsia testicular, ya que el propio medio de cultivo de las SSCs junto con marcadores específicos de células tumorales que se han descrito para poder eliminarlas(16).
Un número de estudios, principalmente en ratones, han evaluado la recuperación de la fertilidad tras el trasplante de SSCs. Ratones trasplantados fueron capaces de producir crías vivas con nacimientos, tasas de crecimiento y fertilidad normales. No se detectaron aberraciones cromosómicas en espermatozoides de su descendencia después del trasplante. Las marcas epigenéticas analizadas después del trasplante de SSCs de ratón fueron las mismas en comparación con el control de la espermatogénesis. Además se trasplantaron SSCs autólogas como alogénicas de primates en rete testis del testículo adulto de primates y tras la restauración de la fertilidad las células espermáticas que fueron capaces de fecundar ooocitos por técnicas de reproducción asistida. Mientras que la demostración de la funcionalidad de la espermatogénesis del donante después del trasplante de SSCs en humanos es un hito importante para restaurar la fertilidad humana, sigue siendo de vital importancia la estabilidad genética y epigenética de las SSCs después del trasplante.
2. Restauración de la fertilidad por autotrasplante del tejido testicular inmaduro
El trasplante de fragmentos de tejido testicular es otra de las estrategias para la restauración de la fertilidad alternativamente a la expansión in vitro y autotrasplante de las SSCs.
Este segundo abordaje para la restauración de la fertilidad es capaz de mantener el nicho natural del testículo, preservando así las interacciones entre las SSCs y las células somáticas de soporte. Gracias a los nutrientes y a las hormonas del propio cuerpo llegarán al injerto e inducirán la espermatogénesis y el esperma resultante se podría extraer y mediante técnicas de reproducción asistida, como fecundación in vitro (FIV) o inyección intracitoplásmica (ICSI, del inglés Intracytoplasmic Sperm Injection) poder fecundar un oocito.
El trasplante autólogo de la biopsia testicular puede realizarse en el propio testículo, en el escroto o ectópicamente bajo la piel.
Se ha descrito en modelo murino que los trasplantes de tejido testicular que se colocan en sitios ectópicos como en el espacio peritoneal o en el oído debajo de la piel se tornan escleróticos o muestran un paro meiótico. También se ha demostrado que el autotrasplante es muy eficiente en modelo de primate no humano, restableciéndose la espermatogénesis completa en trasplantes del tejido testicular en escroto y en testículo intratesticular, siendo esta última la más eficiente(17).
Sin embargo, los trasplantes testiculares de otras especies como cabra, cerdo y humanos en ratones muestran una supervivencia limitada de los tejidos trasplantados además de fibrosis. Aunque los datos indican que los trasplantes de tejido prepuberal muestran una mejor resistencia a la isquemia debido a su naturaleza quiescente, hasta la fecha no se ha observado una maduración del tejido trasplantado solamente hasta el estadio de espermatocito(18). Con el fin de prevenir la isquemia del tejido trasplantado, la suplementación con factor de crecimiento endotelial vascular, así como la realización del trasplante a nivel intratesticular intentando imitar el nicho natural del tejido, podrían mejorar la tasa de éxito de la técnica de xenotrasplante.
Actualmente, el auto-trasplante de la biopsia testicular se considerada otra opción para restaurar la fertilidad en pacientes prepúberes, especialmente en pacientes de Síndrome de Klinefelter, a excepción de los pacientes diagnosticados de cánceres hematológicos, ya que no es aconsejable auto-trasplantar la biopsia por el riesgo de infiltración de alguna célula tumoral residual en la biopsia criopreservada.
3. Espermatogénesis in vitro
Una tercera estrategia para restaurar la fertilidad en este tipo de pacientes prepúberes con cualquier patología descrita en la Tabla III, es mediante la recreación de la espermatogénesis in vitro, o también llamada, diferenciación in vitro de las SSCs a espermatozoides. Uno de los principales problemas anteriormente descritos en pacientes con un diagnóstico de cáncer hematológico previo, es el riesgo de reintroducir células tumorales en el tejido trasplantado. Por tanto, una de las ventajas para estos pacientes es recrear la espermatogénesis in vitro y por consiguiente, una de las opciones iniciales que se planteó para evitar la transferencia de células tumorales, fueron los xenotrasplantes testiculares, pero al haber riesgo de zoonosis, posteriormente se pensó que es muy poco probable que sea una solución clínica aceptable para la restauración de la fertilidad.
En el año 2014 se publicó un estudio que describía la diferenciación in vitro de SSCs humanas de un paciente con criptorquidia a espermátidas redondas y gracias a una técnica de reproducción asistida (ROSI, del inglés, ROund Spermatid Inyection) se logró fecundar oocitos(19).
También gracias a la técnica del cultivo organotípico se ha logrado madurar completamente y probar la funcionalidad de espermatozoides a partir de SSCs en modelo de ratón manteniendo así la estructura e interacciones de todos los tipos celulares del testículo. Sin embargo, datos sobre la viabilidad de esta técnica con tejido humano indican un bloqueo en la maduración de las espermatogonias, acompañado de una pérdida progresiva de células germinales. Para abordar una mejor diferenciación in vitro de la espermatogénesis humana, en la actualidad, se están explorando nuevas estrategias de diferenciación tridimensional(20), como: cocultivos tridimensionales de células germinales inmaduras junto con células somáticas tanto en modelos animales como en humano, el uso de estructuras descelularizadas a partir de tejido testicular humano hacen que sean compatibles con SSCs humanas para una mejora en la diferenciación y en la recreación del nicho testicular humano. Y en último lugar la bioimpresión 3D, con impresoras que utilizan biotintas en combinación con células y recrean así el testículo humano para una mejora en la diferenciación in vitro de las SSCs.
Programa de preservación de fertilidad en niños prepúberes con cáncer o síndrome de Klinefelter en Osakidetza
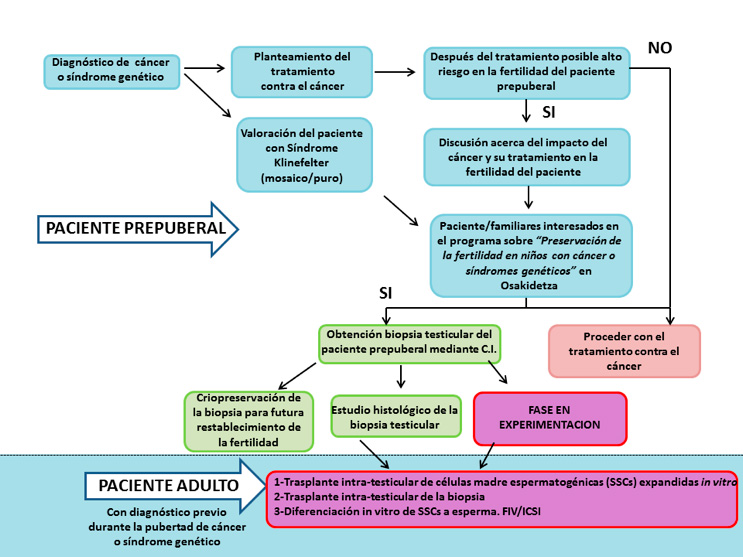
Desde el año 2016, hemos iniciado un programa de preservación de la fertilidad en Osakidetza enfocado para niños prepúberes con cáncer o síndrome de Klinefelter, entre otras patologías. En la Figura 2, se muestra mediante un diagrama de flujo, el protocolo que seguimos desde que se diagnostica la patología al paciente prepuberal hasta que se criopreserva en nuestro Banco de Tejidos del Centro Vasco de Transfusión y Tejidos Humanos. Una vez diagnosticada la patología por el equipo de clínicos del Servicio de Pediatría, Cirugía Pediátrica y Unidad de Reproducción Asistida, se evalúa el riesgo de infertilidad a término futuro, y en el caso de que se considere alto riesgo y si los familiares y el paciente están de acuerdo, se recoge una biopsia testicular, mediante un consentimiento informado. El momento de la cirugía, se aprovecha la anestesia para otra intervención (por ejemplo, reservorio para quimioterapia) para minimizar daños al paciente. El trozo de tejido se trasporta al Banco de Tejidos en medio y tras controles rutinarios se criopreserva en nitrógeno líquido en un medio de criopreservación específico para un futuro uso en clínica. Parte de la biopsia se comprueba la correcta morfología mediante tinción de H-E e inmunofluorescencia para la detección de marcadores específicos de SSCs en cortes de parafina. Además una parte de nuestro programa se basa en la investigación, por tanto un pequeño fragmento se destina a seguir investigando en la mejora de estas estrategias de restauración de la fertilidad como línea de investigación en la Unidad de Terapia Celular y Células Madre del Centro Vasco de Transfusión y Tejidos Humanos.
Conclusiones
Cada vez se conocen más los programas de fertilidad en niños y adolescentes, pero todavía existen centros hospitalarios que los desconocen, y por tanto es necesario una buena difusión y creación de guías o recomendaciones para que estos pacientes puedan beneficiarse en un futuro de estos programas de fertilidad.
Finalmente, como se ha descrito en las diferentes estrategias experimentales de restauración de la fertilidad existen problemas que debemos resolver, que estamos expectantes y que los veremos resueltos eficientemente en los próximos años gracias al trabajo de investigación básica junto con la clínica.
Tablas y figuras
Tabla I. Interpretación de los niveles de hormona antiMülleriana
|
Reserva ovárica estimada |
Niveles sanguíneos de hormona antiMülleriana (ng/ml) |
|
Alta |
>4 |
|
Normal |
1’5-4 |
|
Normal-Baja |
1-1’5 |
|
Baja |
0’5-1 |
|
Muy baja |
<0’5 |
Tabla II. Riesgo estimado de infertilidad según los agentes quimioterápicos y radioterapia utilizados en tratamientos contra el cáncer
|
Riesgo gonadotóxico secundario a tratamientos quimioterápicos |
Agentes y dosis |
|
Riesgo Alto |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Riesgo Intermedio |
|
|
|
|
|
|
|
|
|
|
|
|
Riesgo Bajo
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Riesgo Desconocido |
|
|
Riesgo gonadotóxico secundario a tratamiento con radioterapia |
Dosis |
|
Riesgo Alto |
|
|
|
|
|
|
Riesgo Intermedio |
|
|
*Tabla modificada a partir de las referencias (10,13)
Tabla III. Indicaciones clínicas para preservar tejido testicular inmaduro en niños prepúberes
|
Enfermedades tumorales |
Enfermedades no tumorales y otras patologías o casos |
|
Leucemia Linfoblástica Aguda |
Trasplante de Progenitores Hematopoyéticos |
|
Leucemia Mieloide Aguda |
Drepanocitosis |
|
Linfoma de Hodking |
Talasemia |
|
Linfoma no Hodking |
Aplasia Medular Idiopática |
|
Linfoma de Células B grandes |
Enfermedad Granulomatosa Crónica |
|
Linfoma de Burkitt |
|
|
Cáncer Testicular |
|
|
Neuroblastoma |
Riesgo de degeneración testicular |
|
Ependimoma |
|
|
Osteosarcoma |
Síndrome de Klinefelter |
|
Rabdomiosarcoma |
|
|
Hepatoblastoma |
Vasectomía |
|
Germinoma Craneal |
|
|
Meduloblastoma |
Disgenesia gonadal |
|
Ependimoma Anaplasico |
|
|
Sarcoma de Ewing |
Disforia de género |
|
Carcinoma Nasofaríngeo |
|
|
Sarcoma Pleomórfico Indiferenciado |
|
|
Ganglioglioma |
|
|
Pineoblastoma |
|
*Tabla modificada a partir de la referencia(13).
Figura 1. Programa de preservación de fertilidad en pacientes prepúberes diagnosticados con cáncer o Síndrome de Klinefelter en Osakidetza
Figura 2. Esquema de las diferentes estrategias en fase de experimentación para restaurar la fertilidad a partir de tejido testicular inmaduro
1) Trasplante de SSCs expandidas in vitro; 2) Trasplante de tejido testicular inmaduro; 3) Espermatogénesis in vitro.
Bibliografía
1. Elgindy E, Sibai H, Abdelghani A, Mostafa M. Protecting ovaries during chemotherapy through gonad suppression: a systematic review and meta-analysis. Obstet Gynecol. 2015;126(1):187-95.
2. Goldman RH, Racowsky C, Farland LV, et al. Predicting the likelihood of live birth for elective oocyte cryopreservation: a counseling tool for physicians and patients. Hum Reprod. 2017;32(4):853-859.
3. Van der Ven H, Liebenthron J, Beckmann M et al. Ninety-five orthotopic transplantations in 74 women of ovarian tissue after cytotoxic treatment in a fertility preservation network: tissue activity, pregnancy and delivery rates. Hum Reprod. 2016;31(9):2031-41.
4. Martinez F, on behalf of the International Society for Fertility Preservation–ESHRE–ASRM Expert Working Group. Update on fertility preservation from the Barcelona International Society for Fertility Preservation–ESHRE–ASRM 2015 expert meeting: indications, results and future perspectives. Ferti Steril. 2017;108:407-15.
5. Practice Committee of the American Society for Reproductive Medicine. Testing and interpreting measures of ovarian reserve: a committee opinion. Fertil Steril. 2015;103(3):e9e17.
6. Meirow D, Biederman H, Anderson RA, Wallace WH. Toxicity of chemotherapy and radiation on female reproduction. Clin Obstet Gynecol. 2010;53(4):727e39.
7. Wallace WH, Kelsey TW, Anderson RA. Fertility preservation in pre-pubertal girls with cancer: the role of ovarian tissue cryopreservation. Fertil Steril. 2016;105(1):6-12.
8. Nahata L, Sivaraman V, Quinn GP. Fertility counseling and preservation practices in youth with lupus and vasculitis undergoing gonadotoxic therapy. Fertil Steril. 2016;106:1470-74.
9. Dalle JH, Lucchini G, Balduzzi A, Ifversen M, Jahnukainen K, Macklon KT, et al. State-of-the-art fertility preservation in children and adolescents undergoing haematopoietic stem cell transplantation: a report on the expert meeting of the Paediatric Diseases Working Party (PDWP) of the European Society for Blood and Marrow Transplantation (EBMT) in Baden, Austria, 29-30 September 2015. Bone Marrow Transplant. 2017;52:1029-35.
10. Garrido-Colino C, Lassaletta A, Vazquez MÁ, Echevarria A, Gutierrez I, Andión M, et al; en representación del Comité de Adolescentes de la SEHOP. Current situation on fertility preservation in cancer patients in Spain: Level of knowledge, information, and professional involvement. An Pediatr (Barc). 2017;87(1):3-8.
11. Rives N, Milazo JP, Perdrix A, Castanet M, Joly-He´las G, Sibert L, et al. The feasibility of fertility preservation in adolescents with Klinefelter syndrome. Hum Reprod. 2013;28:1468-79.
12. Medrano JV, Luján S, Andrés MDM, Pellicer A. Current state regarding fertility cryopreservation in pre-pubertal boys. Rev Int Androl. 2018 Nov 23.
13. Picton HM, Wyns C, Anderson RA, Goossens E, Jahnukainen K, Kliesch S, et al; ESHRE Task Force On Fertility Preservation In Severe Diseases. A European perspective on testicular tissue cryopreservation for fertility preservation in prepubertal and adolescent boys. Hum Reprod. 2015;30(11):2463-75.
14. Nickkholgh B, Mizrak SC, Korver CM, van Daalen SK, Meissner A, Repping S, et al. Enrichment of spermatogonial stem cells from long-term cultured human testicular cells. Fertil Steril. 2014;102(2):558-65.
15. Vassena R, Eguizabal C, Heindryckx B, Sermon K, Simon C, van Pelt AM, et al; ESHRE special interest group Stem Cells. Stem cells in reproductive medicine: ready for the patient? Hum Reprod. 2015;30(9):2014-21.
16. Sadri-Ardekani H, Homburg CH, van Capel TM, van den Berg H, van der Veen F, van der Schoot CE, et al. Eliminating acute lymphoblastic leukemia cells from human testicular cell cultures: a pilot study. Fertil Steril. 2014;101(4):1072-1078.e1.
17. Jahnukainen K, Ehmcke J, Nurmio M, Schlatt S. Autologous ectopic grafting of cryopreserved testicular tissue preserves the fertility of prepubescent monkeys which receive a sterilizing cytotoxic therapy. Cancer Res 2012;72:5174–78.
18. Wyns C, Van Langendonckt A, Wese F-X, Donnez J, Curaba M. Long-term spermatogonial survival in cryopreserved and xenografted immature human testicular tissue. Hum Reprod 2008;23:2402–14.
19. Yang S, Ping P, Ma M, Li P, Tian R, Yang H, et al. Generation of haploid spermatids with fertilization and development capacity from human spermatogonial stem cells of cryptorchid patients. Stem Cell Reports. 2014:14;3(4):663-75.
20. Baert Y, Goossens E. Preparation of Scaffolds from Decellularized Testicular Matrix. Methods Mol Biol. 2018;1577:121-7.
Bibliografía recomendada
- 1. Hawkins B, Steiner A. Anti-Müllerian hormone as a predictor of reproductive potential. Curr Opin Endocrinol Diabetes Obes. 2018;25(6):385-390.
- 2. Oktay K, Harvey BE, Partridge AH, Quinn GP, Reinecke J, Taylor HS, et al. Fertility preservation in patients with cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2018;36(19):1994-2001.
- 3. Donnez J, Dolmans MM. Fertility preservation in women. N Engl J Med. 2017;377:1657-65.
- 4. Picton HM, Wyns C, Anderson RA, Goossens E, Jahnukainen K, Kliesch S, et al; ESHRE Task Force On Fertility Preservation In Severe Diseases. A European perspective on testicular tissue cryopreservation for fertility preservation in prepubertal and adolescent boys. Hum Reprod. 2015;30(11):2463-75.
- 5. Vassena R, Eguizabal C, Heindryckx B, Sermon K, Simon C, van Pelt AM, et al; ESHRE special interest group Stem Cells. Stem cells in reproductive medicine: ready for the patient? Hum Reprod. 2015;30(9):2014-21.