Situación actual del Meningococo en España
Situación actual del Meningococo en España
W.A. Goycochea Valdivia
MSc. in Vaccionology and Pharmaceutical Clinical Development. Facultativo Especialista de Área en Pediatría. Servicio de Infectología, Reumatología e Inmunología Pediátrica, Hospital Universitario Virgen del Rocío, Sevilla.
Fecha de recepción: 22 de septiembre 2019
Fecha de publicación: 31 de octubre 2019
Adolescere 2019; VII (3): 52-64
Resumen
|
La enfermedad meningocócica invasiva (EMI) persiste siendo una devastadora entidad con alta letalidad pese a su baja incidencia. El agente causal, Neisseria meningitidis (o meningococo), coloniza la nasofaringe y cuenta con diversos factores de virulencia y mecanismos para evadir al sistema inmune. Conductas propias en la adolescencia favorecen su transmisión entre este y a otros grupos etarios susceptibles a desarrollar la enfermedad (lactantes y adultos mayores). Con una epidemiología siempre dinámica, en Europa y España el serogrupo B persiste como el más frecuente, evidenciándose un incremento de la incidencia de los serogrupos W e Y en los últimos años. La similitud de la EMI con otras enfermedades banales en sus fases iniciales y su rápida progresión dificultan el diagnóstico clínico, precisándose una alta sospecha para la pronta instauración del tratamiento antibiótico y medidas de soporte que puedan mejorar la supervivencia. Dada la letalidad, dificultad diagnóstica y curso tórpido de la EMI, la prevención mediante inmunización activa sigue siendo la mejor estrategia. Hoy contamos con vacunas para los principales serogrupos de meningococo causantes de enfermedad invasiva (A, B, C, W e Y), abriendo la posibilidad a la prevención global de la enfermedad. Palabras clave: Enfermedad meningocócica; Pediatría; Vacunas. |
Abstract
|
Despite its low incidence, invasive meningococcal disease (IMD) is a devastating infection with high mortality. Its causal agent is Neisseria meningitidis (or meningococcus), a nasopharyngeal colonizer, which is favored by different virulence factors and mechanisms designed to evade the immune system. Common behavior in adolescents favors meningococcus transmission between them and to other susceptible age groups (infants and elderly). IMD epidemiology is variable and dynamic, being serogroup B the most frequent in Spain and across many European countries, experiencing an increase in incidence of serogroups W and Y in the latest years. Initial phases of IMD present with signs and symptoms common to other mild diseases, thus making the clinical diagnosis difficult. Without a high level of suspicion, the diagnosis is delayed and IMD can rapidly progress without a prompt administration of antibiotics and other supportive measures to increase survivability. Given its lethality, diagnosis difficulties and torpid clinical course, active immunization still remains the best strategy to prevent IMD. Nowadays, vaccines against the principal serogroups related to IMD (A, B, C, W and Y) are available unlocking the possibility to adopt a global IMD prevention strategy. Key words: Meningococcal invasive disease; Pediatrics; Vaccine. |
Introducción
Neisseria meningitidis o meningococo, es un diplococo Gramnegativo cuya interacción principal con el ser humano es la colonización asintomática de la nasofaringe(1,2). Sin embargo, presenta factores de virulencia que le permiten invadir los tejidos y evadir al sistema inmunológico produciendo la enfermedad meningocócica invasiva (EMI)(1,3,4). Las formas más frecuentes de EMI, la sepsis y la meningitis, pese a su baja incidencia conllevan consecuencias devastadoras incluyendo la muerte y secuelas a largo plazo(5,6).
La EMI se da casi exclusivamente por formas capsuladas del patógeno(1,2). La cápsula polisacárida permite la clasificación en distintos serogrupos, de los 12 serogrupos existentes, 6 (A, B, C, W, Y e X) son los principales causantes de EMI(1,2). La presencia de factores de riesgo específicos, condiciones geográficas y situación inmunológica previa, influyen en la distribución endémica de los distintos serogrupos en diversas partes del mundo(1,2). No obstante, en el actual mundo globalizado la introducción de distintas cepas confiere a su epidemiología un carácter cambiante, como se ha evidenciado en los últimos años en España(1,2,7).
La letalidad y morbilidad de la EMI, su rápida progresión y su epidemiología dinámica e impredecible hacen de las estrategias de prevención y vigilancia herramientas imprescindibles.
Epidemiología
El ciclo de colonización y transmisión del meningococo se circunscribe a su único portador conocido, el ser humano. La transmisión se realiza de persona a persona por vía respiratoria, mediante las gotitas de Flügge ya sea desde portadores asintomáticos o pacientes con enfermedad activa(1).
Aproximadamente, un 5-10% de la población general porta asintomáticamente al meningococo(1,8). La prevalencia de colonización varía según la edad, estimándose un 4-5% en los lactantes, un 20-30% en los adolescentes y menos del 10% en los adultos(1,8,9). La colonización en menores de 5 años suele ser por cepas no capsuladas, siendo infrecuente la colonización por cepas capsuladas hasta la adolescencia(1,9). El modelo de transmisión actual sugiere que el reservorio principal de la bacteria serían los adolescentes, quienes transmitirían las cepas capsuladas con potencial invasivo a los otros grupos etarios(1,9). El desarrollo de EMI se relaciona más con la adquisición de una nueva cepa en comparación con el estado de portador crónico, por lo que interacciones de la bacteria con el sistema inmune del hospedero, sumado a variables físicas, químicas y de microbiota, determinarían el desenlace entre colonización e invasión(1).
Periodos de colonización prolongados, desarrollaría inmunidad natural contra la bacteria y probablemente inmunidad cruzada entre distintas cepas(10). Conductas frecuentes en la adolescencia y los adultos jóvenes que favorece el intercambio de saliva y contacto cercano (besos, fumar, habitar varios individuos en espacios cerrados, compartir bebidas) favorecen la transmisión de la bacteria(1). Estas conductas favorecerían también el intercambio de cepas de meningococo para las cuales no se ha desarrollado inmunidad, o introducción de cepas nuevas en distintas poblaciones, incrementando el riesgo de la EMI tanto para el grupo en cuestión como para sus contactos susceptibles en otros grupos etarios (lactantes y adultos mayores)(9).
La EMI suele tener un tiempo de incubación corto estimado entre 2-10 días (media de 4 días)(8).
Su incidencia suele variar regionalmente a nivel global, presentando un carácter estacional, siendo más frecuente durante los meses de invierno (de noviembre a febrero en España)(8). A nivel mundial, según estimaciones de la OMS se registrarían 500.000 casos y 50.000 muertes por EMI cada año(8). En España, según los datos de la Red Nacional de Vigilancia Epidemiológica (RENAVE), la incidencia de EMI presenta un patrón descendente desde la temporada 1999-2000 a la 2013-2014, a partir de la cual, se registra un ligero ascenso hasta la temporada 2017-2018(7,8,11). En esta temporada se registraron un total de 372 casos (346 confirmados) con una tasa de incidencia por 100.000 habitantes de 0.8 (0.74 para casos confirmados)(7,8,11).
La distribución de los distintos serogrupos e incidencia de EMI por los mismos, sigue un patrón geográfico influenciado en gran parte por la presión vacunal y otros factores no del todo dilucidados. En Europa y en España los casos por serogrupo A son bastante infrecuentes. El serogrupo B persiste siendo el más frecuente en nuestro país, presentando un descenso gradual desde la temporada 1999-2000 (317 casos, incidencia por 100.000 habitantes: 0.69) hasta la 2017-2018 (142 casos, incidencia por 100.000 habitantes: 0.3)(7,8,11). El descenso en la incidencia inicia sin tener una vacuna contra el serogrupo B, cuya disponibilidad no financiada data desde el 2015(7,8,11). Sin embargo, en las últimas 2 temporadas, se han registrado cambios en la incidencia de este serogrupo en distintas edades, disminuyendo la misma en menores de 1 año (grupo objetivo para la inmunización), aumentando en personas de 65 o más años (grupo habitualmente no vacunado)(7). En la temporada 2013-2014 se registraron 50 casos en menores de un año (11.44 por 100.000 habitantes) en comparación con los 34 casos (8.13 por 100.000 habitantes) reportados en la 2015-2016 y los 23 casos (5.85 por 100 000 habitantes) en la 2017-2018(7,8,11). Asimismo, se registra un coincidente descenso en las muertes por el serogrupo B en menores de un año en estas temporadas (ninguna muerte registrada en este grupo en 2017-2018)(7). Aunque estos cambios podrían estar en relación con el uso no financiado de la vacuna, no se puede confirmar el efecto atribuible en ausencia de estudios y datos de cobertura vacunal.
El incremento de la incidencia de EMI en España desde la temporada 2013-2014 se debe principalmente a los casos producidos por los serogrupos C, W e Y(7,8,11). La incidencia del serogrupo C que presentaba un descenso continuo desde la introducción de la vacuna conjugada contra el mismo, ha sufrido un ascenso en las últimas 4 temporadas, registrándose 40 casos en la temporada 2017-2018 (incidencia por 100.000 hab. 0.09)(7,8,11).
La incidencia del serogrupo W se ha incrementado en varios países a nivel mundial(8). Durante la peregrinación anual a la meca (Hajj) del año 2000, se produce un brote epidémico de EMI por serogrupo W, causado por el complejo clonal hipervirulento ST-11CC(2,8,12). La cepa inicial denominada Hajj, se extendió causando EMI en diferentes países de retorno de los peregrinos. Linajes diferentes de la cepa original (“cepa Hajj”, “cepa sudamericana”, “cepa original – Reino Unido” y “cepa 2013 – Reino Unido”) se extienden por América del Sur, y desde ahí a diversos países en Europa(8,13). En Reino Unido se evidencia un incremento de los casos por serogrupo W desde la temporada 2008-2009, con la aparición del linaje “cepa 2013 – Reino Unido” en el 2013 caracterizada por mayor virulencia y rápida expansión(8,13). Se registró un incremento de hasta un 85% de los casos entre las temporadas 2013-2014 y 2014-2015 en este país motivando la introducción de la vacuna tetravalente ACWY a administrarse en los adolescentes(8,13). En España, se observa igualmente un incremento del serogrupo W desde el año 2015, principalmente por las “cepa original – Reino Unido” y “cepa 2013 – Reino Unido”(8,11). En la temporada 2017-2018 se registraron 48 casos de EMI por serogrupo W con una incidencia 0.1, aproximadamente 3 veces mayor a la registrada en la temporada 2009-2010(7,8,11). Aunque la mayor parte de casos en las 3 últimas temporadas se han dado en mayores de 65 años, se registran entre 1-3 casos por temporada en menores de 1 año, 2 casos por temporada en niños 1-4 años y de 1-5 casos en adolescentes(7,8,11). Debido al modelo de transmisión, sería esperable que en ausencia de medidas preventivas pudiesen incrementar los casos en adolescentes y menores de 5 años.
La incidencia del serogrupo Y también ha incrementado de forma considerable en nuestro país de tan sólo 4 casos en la temporada 2009-2010 (0.01 por 100.000 habitantes), hasta 37 casos en la temporada 2017-2018 (0.08 por 100.000 habitantes)(7,8,11). La mayor parte de los casos de EMI por este serogrupo se ha dado en grupos etarios de riesgo: 3 casos (0.37 por 100.000 habitantes) en menores de 5 años, 5 casos (0.22 por 100.000 habitantes) en adolescentes de 15 a 19 años y 19 (0.21 por 100.000 habitantes) casos en mayores de 65 años(7,8,11).
La letalidad global de la EMI en España ha presentado un incremento global en las últimas 5 temporadas, más notoriamente en las 2 últimas, registrándose 44 defunciones (12.7%), duplicando las cifras registradas en 2013-2014(7,8,11). La letalidad y morbilidad de la EMI son de los aspectos más importantes de esta patología. Pese a su baja incidencia, globalmente, se estima que entre un 10-15% de los pacientes fallecerán y hasta un 30% de los sobrevivientes tendrán alguna secuela grave (secuela neurológica, sordera, amputación de miembros)(5). El incremento de la letalidad por EMI en España es más acusado para el serogrupo W y serogrupo C, debido a la circulación de las cepas hipervilurentas del CC-11(11).
Se estima que entre un 10-15% de los pacientes con EMI fallecerán y hasta un 30% de los sobrevivientes tendrán alguna secuela grave (secuela neurológica, sordera, amputación de miembros)
Fisiopatología
Muchos de los factores implicados en el ciclo de colonización y transmisión de la bacteria, pueden actuar también como factores de virulencia con potencial invasivo(1,14). La envoltura celular de la bacteria consta de 3 capas: una membrana citoplasmática interna, una membrana citoplasmática externa (MCE) y una pared celular de peptidoglicano entre ambas capas(1,14). Esta envoltura celular puede estar rodeada o no por una cápsula polisacárida(1,14). La MCE contiene proteínas de membrana externa (PME), lipopolisacáridos / lipoolisacáridos (LPS/LOS) y fosfolípidos(1,14).
La cápsula le permite al meningococo sobrevivir durante el proceso de transmisión, pero también le confiere la habilidad de sobrevivir al complemento en sangre inhibiendo la fagocitosis en el caso de cepas invasoras(1,14,15). Las PME desempeñan funciones destinadas a satisfacer las necesidades nutricionales y metabólicas de la bacteria, pero muchas de ellas colaboran con el proceso de colonización e invasión mediante su unión a moléculas de adhesión celular y proteoglicanos. Algunas poseen también propiedades inmunomoduladores como la proteína de unión al factor H (fHbp). Esta es expresada por el meningococo para unir a su superficie el factor H del ser humano, un potente regulador negativo de la activación de la vía alternativa del complemento permitiendo la subsistencia de la bacteria en el suero(1,14–16).
La proteína de unión al factor H (fHbp) es expresada por el meningococo para unir a su superficie el factor H del ser humano, un potente regulador negativo de la activación de la vía alternativa del complemento permitiendo la subsistencia de la bacteria en el suero
De forma natural, porciones de la MCE pueden separarse del resto de la membrana y excretarse al exterior(1,14,15). Estas vesículas de membrana externa (VME) contienen PME y LPS/LOS que juegan un papel importante en la inmunomodulación y la aparición de las manifestaciones clínicas de la EMI(1,14,15). Cuando se ha producido la invasión a nivel sanguíneo, se excretan las VME interactuando los LPS/LOS con el sistema inmune innato, activándose una cascada inflamatoria con secreción de diversas citoquinas y mediadores que resultan en el daño endotelial y la fuga capilar característicos de la sepsis meningocócica(1). Esta respuesta puede confinarse a nivel del tejido diana (por ejemplo, las meninges), produciendo un daño significativo del mismo(1).
La inmunidad frente al meningococo está mediada por la interacción entre el sistema inmune innato y adaptativo(3,10). Los anticuerpos con capacidad para fijar el complemento se consideran bactericidas y pueden producirse mediante exposición natural o inmunización activa(1,15). Los anticuerpos dirigidos contra la cápsula polisacárida han demostrado ser eficaces para prevenir la EMI, reduciendo también la tasa de colonización nasofaríngea(1,3,14). Los anticuerpos pueden unirse también a las PME, manteniendo actividad bactericida preventiva contra la EMI, pero con escaso impacto sobre la colonización nasofaríngea según la evidencia actual(15,17). Los anticuerpos anticapsulares son específicos para cada serogrupo, mientras que en el caso de anticuerpos contra PME, podrían mantener protección cruzada entre distintos serogrupos y cepas dependiendo del grado de conservación y similitud de las proteínas entre ellas(3).
Los anticuerpos dirigidos contra la cápsula polisacárida han demostrado ser eficaces para prevenir la EMI, reduciendo también la tasa de colonización nasofaríngea
Complementariamente a fHbp, el meningococo cuenta con diversos mecanismos para evadir al sistema inmune. La cápsula se compone por derivados del ácido siálico (excepto para el serogrupo A), presentes también en el ser humano, permitiendo evadir al sistema inmune por mimetismo molecular(14). Particularmente, la cápsula del serogrupo B contiene un derivado de ácido siálico idéntico a la molécula de adhesión celular neuronal fetal(14). El meningococo cuenta además con la capacidad de adquirir genes capsulares de otros serogrupos, pudiendo cambiar la expresión antigénica capsular en un fenómeno denominado “capsular switching”(1). Adicionalmente, tiene la capacidad de modificar la expresión en superficie de las distintas PME según se requiera(3).
Clínica
Durante la colonización asintomática el sujeto no presenta alteración alguna evidenciable, pero mantiene la capacidad de transmisión del patógeno. La EMI puede presentarse como sepsis con y sin meningitis (aproximadamente en el 20% y 30% de los casos, respectivamente), meningitis aislada (aproximadamente en el 40% de los casos) u otros síndromes (aproximadamente 10% de los casos)(5).
Se caracteriza por ser rápidamente progresiva con síntomas inespecíficos al inicio del cuadro que son indistinguibles de otras infecciones habituales y banales (Figura 1)(5,6).
La EMI puede presentarse como sepsis con y sin meningitis, meningitis aislada u otros síndromes. Se caracteriza por ser rápidamente progresiva con síntomas inespecíficos al inicio del cuadro que son indistinguibles de otras infecciones habituales y banales
En las primeras 8 horas el paciente suele presentar fiebre, cefalea y odinofagia, pudiendo asociar en las horas posteriores malestar general, náuseas, vómitos y apetito disminuido o irritabilidad en los lactantes(5,6). Los síntomas característicos reconocidos de la EMI suelen aparecer sobre las 12-15 horas de evolución del cuadro, pudiendo presentar el paciente la aparición de un rash purpúrico o petequial, somnolencia, frialdad de manos o pies y meningismo (rigidez de nuca, signo de Kernig, signo de Brudzinski) si asocia meningitis(5,6). Sin tratamiento, en las siguientes horas puede evolucionar a una púrpura fulminante con hipotensión, sangrado suprarrenal, shock séptico y fallo multiorgánico con un desenlace mortal en 24 horas (Figura 1)(5,6).
Algunos síntomas menos frecuentes pueden presentarse, incluyendo conjuntivitis, artritis, epiglotitis, otitis media, uretritis y dificultad respiratoria entre otros(1,2). Especial mención merecen los síntomas gastrointestinales como la diarrea y los vómitos que se han asociado a la cepa hipervirulenta ST-11 del serogrupo W actualmente en circulación, reportados particularmente en adolescentes(1,2). La cefalea persistente de aparición súbita, asociada a confusión o disminución del nivel de conciencia suelen ser una forma de presentación de la meningitis meningocócica en el adolescente que se suele confundir con otras causas (cefalea inespecífica, trastorno conversivo, consumo de alcohol o drogas) retrasando el diagnóstico(6).
Diagnóstico
Debido a la inespecificidad de los síntomas en las fases iniciales sumado a su rápida y fulminante progresión, el diagnóstico precoz de la EMI permanece como un reto para los profesionales médicos(6). El éxito del tratamiento disminuye considerablemente con el paso de las horas, por lo cual se debe mantener un nivel de sospecha alto en los pacientes pediátricos que acudan con enfermedad febril(18). La confirmación diagnóstica se realiza con métodos microbiológicos y/o moleculares, pero el diagnóstico inicial es clínico y se realiza mediante la identificación de los signos y síntomas mencionados anteriormente (Figura 1)(5,6).
En todo paciente pediátrico febril, particularmente en los que presenten factores de riesgo (lactantes, menores de 5 años, adolescentes, déficit del complemento, asplenia, EMI previa) se debe buscar activamente los síntomas y signos referidos. La asociación de malestar general importante, frialdad en manos y pies, color anómalo de la piel, cefalea intensa no atribuible a otras causas, o irritabilidad en el lactante, pueden ser signos precoces(6). También se han descrito los síntomas gastrointestinales asociados al serogrupo W clon ST-11(2). En caso de sintomatología inespecífica con buen estado general, tanto el personal sanitario como los cuidadores del paciente deben tener en cuenta que las manifestaciones pueden variar evolutivamente en el tiempo y deben permanecer alerta ante la aparición de signos de alarma(6).
En todo paciente pediátrico febril, particularmente en los que presenten factores de riesgo (lactantes, menores de 5 años, adolescentes, déficit del complemento, asplenia, EMI previa) se debe buscar activamente los síntomas y signos de EMI. También se han descrito los síntomas gastrointestinales asociados al serogrupo W clon ST-11
La aparición de petequias y/o meningismo en los pacientes febriles debe alertar al clínico sobre la inminente posibilidad de EMI(5,6). La identificación precoz de signos de síndrome de respuesta inflamatoria sistémica o datos de shock (tiempo de relleno capilar >2 segundos, taquicardia, hipotensión, dificultad respiratoria, confusión o disminución del nivel de conciencia) es de vital importancia para instaurar precozmente el soporte requerido(5,6,18).
En pacientes con sospecha de EMI, las pruebas analíticas complementarias mostrarán leucocitosis, neutrofilia, incremento de los reactantes de fase aguda (proteína C reactiva, procalcitonina y velocidad de sedimentación) y alteraciones de la coagulación. El análisis de líquido cefalorraquídeo (LCR) muestra pleocitosis, hiperproteinorraquia e hipoglucorraquia(18). En los pacientes con sepsis meningocócica es habitual encontrar alteraciones metabólicas incluyendo hipoglucemia, hiponatermia, hipokalemia, hipocalcemia, hipomagnesemia, hipofosfatemia y acidosis metabólica(1).
Para la confirmación diagnóstica se precisa la identificación del meningococo en muestras estériles (LCR, sangre, lesiones en la piel) mediante observación directa, aislamiento o técnicas moleculares(1).
La tinción de Gram permite la identificación mediante la visualización de diplococos Gramnegativos en muestras de LCR o lesiones de la piel. En ausencia de tratamiento antibiótico previo, el aislamiento del meningococo en hemocultivos se obtiene en un 40-70% de los casos y hasta en un 90% de cultivos de LCR(1). En caso de haber recibido antibióticos previamente, la rentabilidad de estas pruebas baja considerablemente a menos del 10% para los hemocultivos y menos del 50% para cultivos de LCR(1).
El uso de técnicas moleculares como la reacción en cadena de la polimerasa (PCR) ha permitido mejorar la sensibilidad y especificidad diagnóstica a cifras superiores al 90%(1). Mediante PCR es posible identificar el DNA del meningococo en suero, plasma y LCR, no viéndose afectado por el uso previo de antibióticos(1). Esto es de gran utilidad para la confirmación diagnóstica en caso la punción lumbar deba diferirse hasta la estabilización del paciente afecto de inestabilidad hemodinámica, incremento de la presión intracraneal o coagulopatía(1). Adicionalmente, mientras los cultivos precisan entre 24-72 horas, la PCR obtiene resultados en 4-8 horas(1).
El uso de técnicas moleculares como la reacción de cadena de polimerasa (PCR) ha permitido mejorar la sensibilidad y especificidad diagnóstica a cifras superiores al 90%. Mediante PCR es posible identificar el DNA del meningococo en suero, plasma y LCR, no viéndose afectado por el uso previo de antibióticos
Diagnóstico diferencial
En las fases iniciales de la EMI, esta es indistinguible de procesos infecciosos no graves como infecciones víricas inespecíficas, faringoamigdalitis o gastroenteritis aguda(6). Una vez instaurados los signos y síntomas específicos de la enfermedad, el diagnóstico diferencial debe hacerse con otras infecciones bacterianas invasivas: Streptoccocus pneumoniae, Haemophilus influenzae, Streptococcus pyogenes y Staphylococcus aureus(1,18). En caso de meningitis, se debe tener en cuenta también a virus y otras bacterias frecuentes en poblaciones especiales: Enterobacterias en neonatos, Pseudomonas aeruginosa en neutropénicos e inmunodeprimidos, Staphylococcus epidermidis, Enterococcus sp. y Enterobacterias en portadores de sistemas de derivación ventricular y Listeria monocytogenes en inmunodeprimidos o situaciones de brote epidémico(1,18). En pacientes con cefalea, convulsiones o alteración del nivel de conciencia deben descartarse otras causas de hipertensión intracraneal y el consumo de alcohol o drogas(1,18).
Tratamiento
El tratamiento de la EMI se basa en 2 pilares fundamentales: la precoz administración de tratamiento antibiótico y la aplicación de medidas de soporte cuando se precise(1,18). Ante una clara sospecha de EMI, el tratamiento antibiótico nunca deberá retrasarse, debiendo instaurarse a la espera de la confirmación diagnóstica(1,18).
El tratamiento de la EMI se basa en 2 pilares fundamentales: la precoz administración de tratamiento antibiótico (cefalosporinas de tercera generación de elección) y la aplicación de medidas de soporte cuando se precise. Ante una clara sospecha de EMI, el tratamiento antibiótico nunca deberá retrasarse, debiendo instaurarse a la espera de la confirmación diagnóstica
El tratamiento antibiótico empírico de elección en nuestro medio es el uso de una cefalosporina de tercera generación administrada por vía parenteral (para meningitis se recomienda usar las dosis más altas): Ceftriaxona (75-100 mg/kg/día, máximo 4 gr. al día dividido en 1-2 dosis) o Cefotaxima (200-300 mg/kg/día, máximo 8 gr. al día dividido en 4 dosis)(1,18). Esta estrategia es prudente considerando la posible presencia de cepas resistentes a Penicilina (reportadas en España en algunos estudios antiguos en torno al 40%) y la cobertura en el diagnóstico diferencial de otras potenciales infecciones bacterianas invasivas (Haemophilus influenzae y Streptococcus pneumoniae resistente a Penicilina)(1,18). En lugares con alta prevalencia de Streptococcus pneumoniae resistente a Penicilina y Cefalosporinas, se recomienda añadir Vancomicina al tratamiento empírico(1,18).
Confirmado el diagnóstico se puede continuar el tratamiento dirigido con Ceftriaxona o Cefotaxima u optar por el uso de Penicilina G (250 000- 300 000 U/kg/día, máximo 12 millones U al día, dividido en 4-6 dosis) en cepas con una concentración mínima inhibitoria < 0.1 μg/ml para este antibiótico(1,18).
En pacientes con alergia a betalactámicos, Cloranfenicol (75-100 mg/kg/día, máximo 2 gr. al día, dividido en 4 dosis al día) es una alternativa efectiva, que suele utilizarse como tratamiento estándar en países de bajos recursos(1). Un ensayo clínico randomizado controlado realizado en Turquía encontró una mayor frecuencia de aparición de lesiones necróticas en piel en pacientes tratados con Penicilina G intravenosa en comparación con aquellos tratados con Ceftriaxona; mientras que algún ensayo sugiere también tasas más rápidas de esterilización con cefalosporinas de tercera generación en comparación con Ampicilina o Cloranfenicol(1).
Habitualmente se recomiendan 7 días de tratamiento para la sepsis meningocócica, no existiendo estudios controlados que soporten esta recomendación(19). La evidencia actual sugiere que 4-5 días (Nivel de evidencia CIII) serían igual de eficaces para formas no complicadas(19). Para la meningitis meningocócica se recomienda de 5-7 días (Nivel de evidencia BII)(19). Tanto en la sepsis como meningitis, se recomienda completar el total de tratamiento por vía parenteral (Nivel de evidencia DIV)(19). Para otros síndromes infecciosos causados por el meningococo (osteomielitis, artritis, endocarditis, neumonía), no se ha definido con exactitud la duración óptima del tratamiento y se recomienda consultar con un experto en estas situaciones.
El tratamiento de soporte debe instaurarse en aquellos que lo necesiten con la mayor prontitud posible. El shock séptico meningocócico requiere una resucitación con fluidos agresiva y soporte vasoactivo para mantener la perfusión tisular(18). La cantidad de fluidos que se precisa puede ser muy superior al volumen sanguíneo circulante, pudiendo favorecer el riesgo de edema pulmonar que se desencadena también por pobre perfusión pulmonar e hipoxia, pudiendo requerir el paciente intubación electiva(1,18). Tanto las alteraciones metabólicas como la coagulopatía deben ser corregidas, mientras que medidas de soporte renal y para el control de la presión intracraneal pueden ser requeridas(1,18). El uso de soporte agresivo y precoz es crítico para mejorar la supervivencia del paciente y reducir el riesgo de desarrollo de secuelas(1,18).
El uso de terapias adyuvantes es controvertido, debido a que hay poca evidencia de su eficacia en pediatría(1,18). El uso de corticoesteroides ha demostrado beneficio en otras causas de meningitis y en algunos estudios en adultos(1,18). Si se opta por su uso, la pauta habitual es dexametasona 0.15 mg/kg cada 6 horas durante 4 días(1,18). El uso de hidrocortisona a dosis fisiológicas podría tener algún valor en pacientes pediátricos con shock refractario asociado a alteraciones de la respuesta de la glándula suprarrenal(1,18). Existen otras terapias adyuvantes propuestas para el manejo del shock y de la sepsis meningocócica, incluyendo plasmaféresis y otras terapias dirigidas al bloqueo de endotoxinas y mediadores inflamatorios; no obstante, no cuentan con suficiente evidencia para emitir un grado de recomendación(1,18).
Prevención
Pese a las mejoras en el desarrollo de técnicas diagnósticas, antibióticos, medidas de soporte y una mayor conciencia de enfermedad y sospecha clínica; la letalidad y morbilidad de la EMI permanecen casi invariables a través del tiempo. Por ello la mejor estrategia es la prevención.
La letalidad y morbilidad de la EMI permanecen casi invariables a través del tiempo pese a los avances en métodos diagnósticos y tratamiento. La mejor estrategia anta una enfermedad tan devastadora y de rápida progresión, es la prevención mediante inmunización activa, considerando que contamos con vacunas contra todos los serogrupos principales
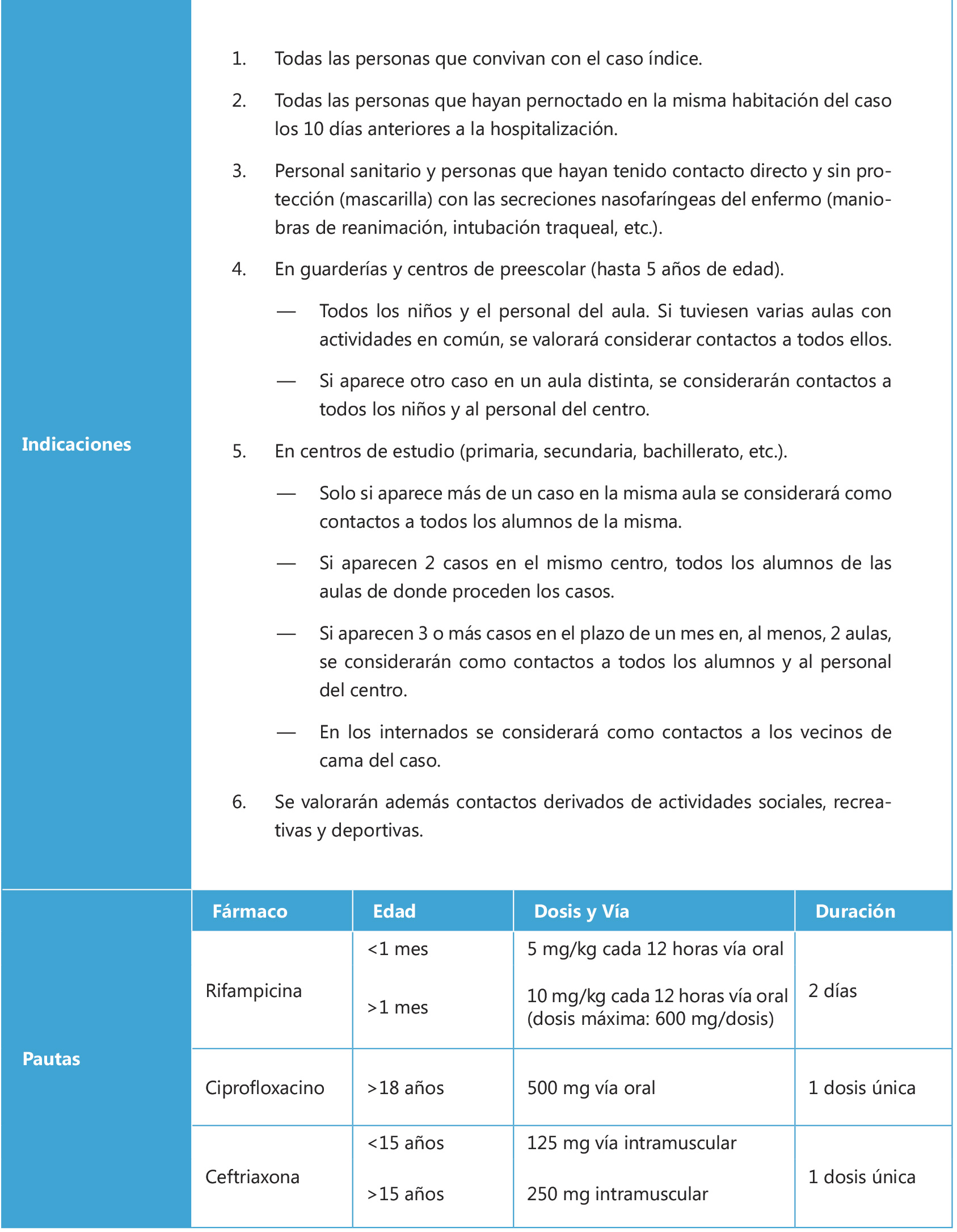
La quimioprofilaxis antimeningocócica para los contactos de un caso índice es fundamental para evitar los casos secundarios (Tabla I), debido al alto riesgo que tienen estos contactos en los 7-10 días posteriores(8). Sin embargo, la medida general más efectiva para la prevención de la enfermedad sigue siendo la inmunización activa, más aun considerando que hoy contamos con alternativas para los serogrupos más frecuentes(1,2,8).
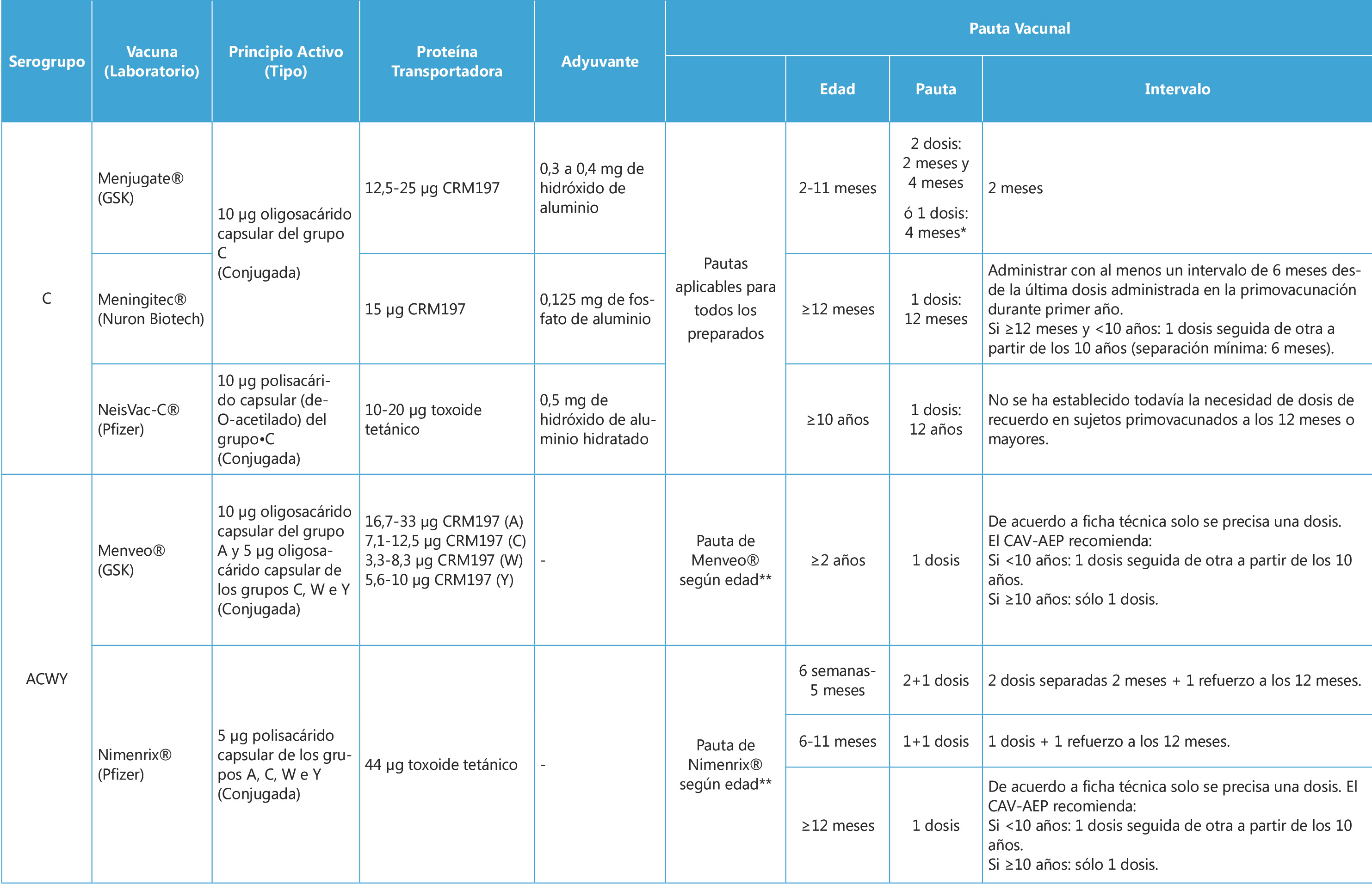
En España contamos con 7 vacunas para la prevención de la EMI: 3 conjugadas monovalentes para el serogrupo C, 2 conjugadas tetravalentes para los serogrupos ACWY y 2 proteicas para el serogrupo B(8). Sus características y pautas se resumen en la Tabla II. Las vacunas conjugadas utilizan como antígeno la cápsula polisacárida del meningococo, unido a una proteína llamada en inglés “carrier”, que permite producir una inmunidad de tipo T-dependiente donde la intervención de las células T, favorece la estimulación de células B para producir anticuerpos con actividad bactericida que presenten mayor afinidad, con respuestas más inmunógenas en lactantes y desarrollo de memoria inmunológica(1). La conjugación es una estrategia aplicable a los serogrupos A, C, W e Y, pero no para el serogrupo B, debido a la alta similitud del ácido polisiálico ligado α2-8 contenido en su cápsula con las glicoproteínas sialisadas α2-8 humanas (moléculas de adhesión celular neural en el feto)(15,17).
Consiguientemente, el uso de la cápsula del serogrupo B como antígeno conllevaba el riesgo de producir pobre inmunogenicidad, o estar relacionado con el desarrollo de autoinmunidad(15,17). Por ello no se tuvo durante mucho tiempo una alternativa para la prevención de ese serogrupo hasta el desarrollo de vacunas proteicas que utilizan como antígenos las PME, donde el reto consiste en buscar métodos para identificar aquellas que serían inmunógenas, conservadas entre distintas cepas y partícipes en la fisiopatología de la EMI(15–17).
La estrategia seleccionada para la prevención de EMI mediante inmunización activa es variable de acuerdo con el tipo de vacuna y según cada país, sin existir una fórmula que se aplique a todos los casos por igual(8). En España hasta hace poco, la única vacuna financiada de forma sistemática era la vacuna conjugada monovalente contra el serogrupo C que se administraba a los 4 meses, 12 meses y 12 años de edad(8). Los cambios epidemiológicos suscitados en los últimos años con respecto al serogrupo W e Y, han motivado que la Ponencia de Programa y Registro de Vacunaciones del Ministerio de Sanidad, Consumo y bienestar Social del Gobierno de España (PPRV), proponga en marzo del 2019 la inclusión de la vacunación frente a los serogrupos ACWY a los 12 años en sustitución de la vacunación frente al serogrupo C y la realización de una vacunación de rescate en adolescentes nacidos entre 2001 y 2006(11).
Esta estrategia, adoptada también por otros países europeos, se basa en la capacidad de las vacunas conjugadas para disminuir la tasa de colonización. Se tiene como objetivo al reservorio (adolescentes) para, mediante efecto de protección indirecta, reducir la incidencia de EMI en los demás grupos(11,13). No obstante, esta estrategia precisa alcanzar rápidamente coberturas altas para ser efectiva, como se deduce de la experiencia en Reino Unido(13,20). El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) sugiere también la sustitución de la vacunación frente al serogrupo C por la vacunación frente a los serogrupos ACWY a los 12 meses de edad, optando por una estrategia utilizada en otros países para garantizar protección directa a este grupo vulnerable mientras se alcanza coberturas vacunales óptimas en el reservorio(8,21). Las 2 vacunas conjugadas tetravalentes disponibles difieren en la proteína “carrier” utilizada, estando autorizada la vacuna conjugada con toxoide tetánico (Nimenrix ® – MenACWY-TT) a partir de las 6 semanas de edad y la vacuna conjugada con CRM-197 (Menveo ® – MenACWY-CRM197) a partir de los 2 años(8). La persistencia de anticuerpos protectores depende de la edad de vacunación(8). Para MenACWY-CRM197 existen datos de persistencia estudiados hasta los 6 años(22), mientras que para MenACWY-TT hay estudios en marcha que sugieren una persistencia de hasta 10 años(8). Recientemente (febrero del 2019), MenACWY-TT ha conseguido la autorización de cambio en su posología, en base a un estudio que demostraba que la inmunogenicidad obtenida mediante pauta de 1 dosis a partir de los 6 meses de edad es similar a la obtenida con 3 dosis (2, 4, 6 meses de edad) en el primer año de vida(8). Esta modificación podría abrir nuevas opciones en el futuro para facilitar cambios programáticos en la inmunización preventiva del lactante contra los serogrupos ACWY(8).
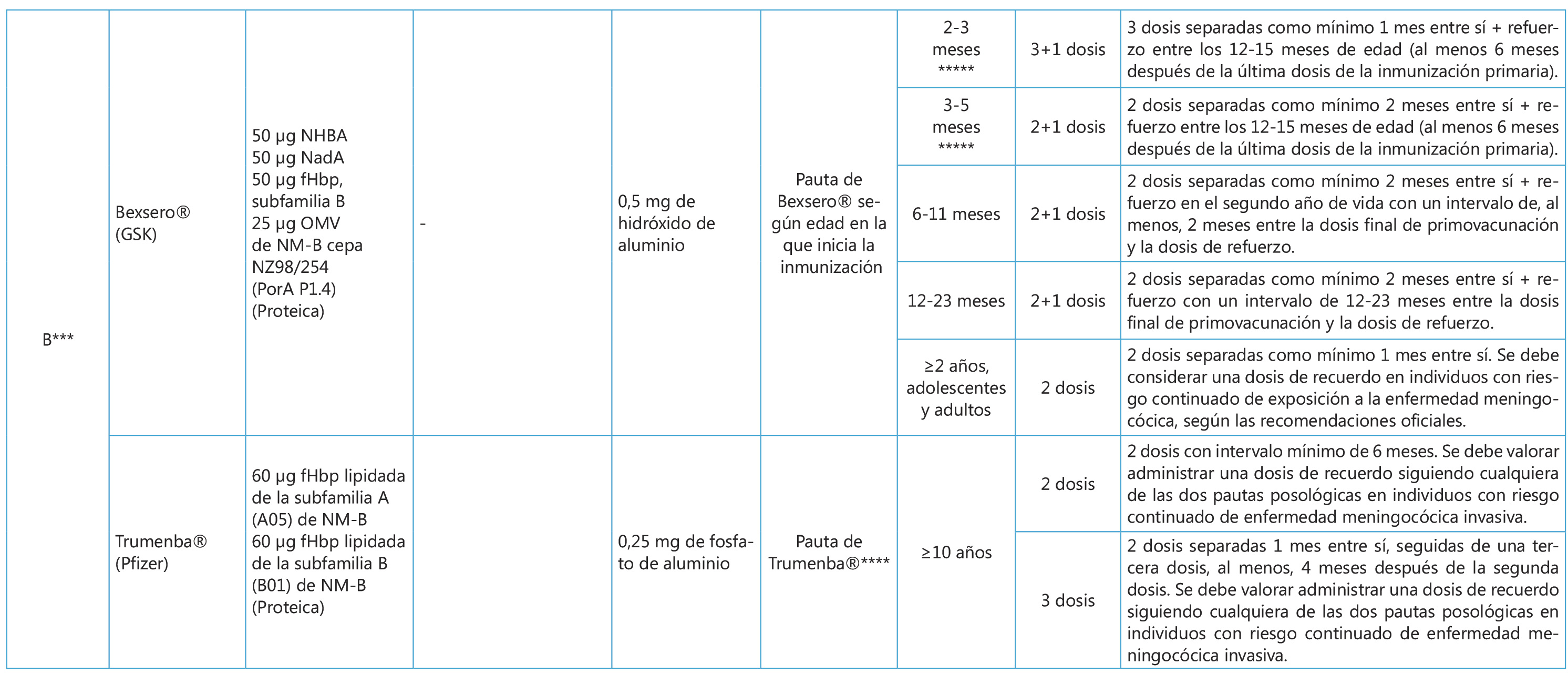
En cuanto al meningococo B, su financiación sistemática sigue siendo un tema de debate en nuestro medio. La PPRV en su revisión de marzo del 2019 no considera la vacunación sistemática frente al serogrupo B en este momento, mientras que el CAV-AEP sigue considerando que la vacuna frente al meningococo del serogrupo B presenta un perfil de vacuna sistemática recomendando su administración en el lactante a los 3, 5 y 12 meses de edad(8,11,21). El CAV-AEP sugiere también su uso en otras edades pediátricas, incluida la adolescencia, realizando una recomendación de tipo individual(8,21).
A diferencia de las vacunas conjugadas que llevan mucho tiempo disponibles, siendo bien conocidos sus datos de eficacia y sus efectos de protección de grupo (parámetros importantes para la instauración de medidas sanitarias públicas), la experiencia con vacunas proteicas frente al serogrupo B es menor. Siendo imposible realizar ensayos clínicos controlados debido a la baja incidencia de la enfermedad y su letalidad, la aprobación de vacunas meningocócicas suele basarse en estudios de inmunogenicidad confirmando el desarrollo de títulos adecuados de anticuerpos bactericidas en suero tras la inmunización(15,17).
La vacuna del meningococo B, sigue siendo un tema de debate en nuestro medio. La PPRV en su revisión de marzo del 2019 no considera la vacunación sistemática frente al serogrupo B en este momento, mientras que el CAV-AEP considera que presenta un perfil de vacuna sistemática recomendando su administración en el lactante a los 3, 5 y 12 meses de edad y sugiere también su uso en otras edades pediátricas, incluida la adolescencia, realizando una recomendación de tipo individual
La cápsula polisacárida es un elemento invariable en cada serogrupo, mientras que las proteínas con función antigénica contenidas en estas vacunas pueden presentar variabilidad en su composición y expresión(15,17). La vacuna tetrantigénica (Bexsero® – 4cMenB) contiene 3 antígenos obtenidos mediante “vacunología inversa”: Una variante de una de las subfamilias de fHbp, la adhesina A de Neisseria meningitidis (NadA) y el antígeno de Neisseria de unión a la heparina (NHBA) que se unen a la VME de Neisseria meningitidis NZ 98/254 que contiene la PME PorA serosubtipo 1.4; y está aprobada a partir de los 2 meses de edad. La vacuna biantigénica (Trumenba® – fHbpMenB) se compone por dos variantes lipidadas de las dos subfamilias de fHbp (A05 y B01); y está aprobada a partir de los 10 años de edad(15-17). Ambas vacunas utilizan distintas estrategias válidas para garantizar la cobertura de las cepas circulantes. 4cMenB utiliza distintos antígenos concibiendo aumentar la probabilidad de cobertura mediante la presencia de al menos alguno de ellos que confiera susceptibilidad a la actividad bactericida por anticuerpos (ABA)(15-17). En el caso de fHbpMenB se incluye las dos variantes más representativas del antígeno implicado en la evasión de la respuesta inmune del huésped concibiendo su expresión en cantidades suficientes en casi todas las cepas circulantes para ser susceptibles a la ABA(15,16). La persistencia de anticuerpos con actividad bactericida se ha estudiado hasta los 4 años con fHbpMenB, mientras que para 4cMenB se ha reportado persistencia hasta los 36 meses en lactantes, decayendo los títulos a los 4 años pero con robustas respuestas de memoria tras las dosis de refuerzo(15-17). En adolescentes vacunados con 4cMenB se ha demostrado persistencia de estos anticuerpos hasta los 7.5 años(23).
Se han desarrollado diferentes sistemas de estimación de la cobertura de cepas (y por tanto no comparables) para 4cMenB y fHbpMenB, en función a la variabilidad de la presencia y expresión de sus antígenos vacunales(15,16). En el caso de España, el estimador utilizado para 4cMenB sugería una cobertura del 70%, mientras que el estimador utilizado para fHbpMenB estimaba una cobertura mayor al 91% en cepas recogidas en 7 países europeos, Estados Unidos y Canadá(15,16). Además de inmunógenas, ambas vacunas han demostrado ser efectivas en situaciones de brotes suscitados en distintas universidades de Estados Unidos, incluyendo la experiencia con 4cMenB para el control de un brote en la región de Saguenay-Lac-Saint-Jean en Quebec, Canadá(15-17). En el caso de 4cMenB, se tienen además datos de efectividad vacunal tras su introducción en el calendario sistemático en el Reino Unido en 2015 para la inmunización de lactantes menores de 1 año(15-17). En el primer año se publicó una efectividad vacunal contra la EMI tras 2 dosis de 4cMenB del 82.9% (24.1% a 95.2%), con una reducción del 50% en la incidencia de casos en la población objetivo(15-17). Esta reducción alcanzó un 72% y un 60% en el segundo y tercer año del programa, respectivamente, publicándose en octubre del 2018 una efectividad del 70% para todas las cepas de meningococo B y del 88% para las cepas cubiertas por la vacuna estimando que se han evitado hasta 250 casos de EMI en los 3 últimos años(20). 4cMenB ha sido incluida también en el calendario vacunal de Irlanda, Italia, Lituania y para adolescentes en el sur de Australia(17).
Tras la experiencia acumulada con ambas vacunas, se garantiza también su seguridad. La inclusión de elementos lipídicos en su composición deriva en una mayor reactogenicidad, reportándose fiebre (sobre todo en lactantes), dolor e inflamación en el lugar de la inyección, siendo en la mayoría de los casos efectos transitorios y tolerables(15). En el caso de 4cMenB, la fiebre tras la vacunación suele ser leve apareciendo a las 6 horas y no durando más de 48 horas. Se ha visto que aumenta su incidencia al coadministrar 4cMenB con otras vacunas sistemáticas del lactante, pudiendo reducirse su aparición separando su administración de estas al menos 2 semanas o mediante el empleo de paracetamol profiláctico(8,15).
El uso de proteínas como antígenos podría tener efectos adicionales que se están evaluando, considerando que tanto los serogrupos no-B como otras especies de Neisseria podrían expresar proteínas similares(17). Desafortunadamente, a diferencia de las vacunas conjugadas, ninguna de las 2 vacunas proteicas contra el serogrupo B han demostrado tener un impacto significativo contra la colonización y el estado de portador asintomático(17).
Los efectos de protección indirecta a nivel comunitario y la reducción en la incidencia de casos de EMI son factores influyentes en la decisión de la inclusión de la vacuna en el calendario oficial de inmunización. En nuestro medio, al momento actual, la financiación de la inmunización contra el serogrupo B sólo está considerada en situaciones de alto riesgo (Tabla II). La experiencia en otros países como Reino Unido sugieren que el análisis coste-efectividad de esta intervención es complicado(15,17). El grado de incertidumbre en parámetros fundamentales que se aplican en los análisis habituales ante vacunas realizadas por nuevas costosas tecnologías sumado a la dificultad para cuantificar el real impacto que conlleva cada caso de EMI más allá de la afectación del paciente (coste social, calidad de vida pérdida, impacto en las familias, confianza en el sistema, entre otros), dificultan balancear una decisión que deba velar por mantener el bienestar económico y social. Por otro lado, el hecho de que estas vacunas no sean financiadas no invalida sus propiedades demostradas con la evidencia actual para la prevención de la EMI por el serogrupo B mediante protección directa(15–17,20).
Considerando la variable epidemiología de la EMI, la evidencia acumulada y las devastadoras consecuencias de cada caso, resulta coherente que comunidades científicas recomienden la inmunización como sugiere el CAV-AEP, de manera sistemática a los lactantes a partir de los 3 meses de edad utilizando la vacuna aprobada para esta edad (4cMenB)(8). A partir de los 10 años de edad la prevención puede realizarse con cualquiera de las 2 vacunas disponibles (4cMenB o fHbpMenB) recordando que las dosis no son intercambiables entre sí(8). Descartando los aspectos económicos y atendiendo a aspectos meramente científicos y clínicos, el cambio paradigmático de una protección dirigida reactiva en función a los cambios de incidencia de los distintos serogrupos, por el de una visión de prevención global contra todos los tipos de EMI se hace razonable, considerando que hoy contamos con las herramientas necesarias para este objetivo.
Esta visión de prevención global está siendo adoptada por distintas comunidades autónomas en nuestro país, con la buena noticia de añadir a las vacunas contra los serogrupos ACWY la inmunización sistemática frente al serogrupo B en Castilla y León y en Canarias; así como su previsible extensión a otras comunidades. Estas decisiones pueden generar, ciertamente, inequidad en nuestro medio en falta de una estrategia unificada. Pero puede ser el llamamiento al cambio de visión que se precisa para entender que la prevención total de la EMI es posible y que lamentablemente las reglas que se aplican para la evaluación de otras intervenciones son difíciles de instaurar en la EMI por serogrupo B; entendiendo que probablemente sólo la introducción de la vacuna en calendarios sistemáticos sumados a un estrecho seguimiento epidemiológico para la evaluación de su efectividad puede dilucidar las dudas sobre el verdadero valor de la intervención.
La visión de prevención global, está siendo adoptada por distintas comunidades autónomas en nuestro país, con la buena noticia de añadir a las vacunas contra los serogrupos ACWY la inmunización sistemática frente al serogrupo B en Castilla y León y en Canarias; así como su previsible extensión a otras comunidades
Tablas y figuras
Tabla I. Quimioprofilaxis para contactos de caso índice de enfermedad meningocócica invasiva
Adaptado de:
– Manual de vacunas en línea de la AEP. Capitulo 30. Meningococos.
http://vacunasaep.org/documentos/manual/cap-30#12.9
– Guía ABE. AEPap. Meningitis Bacteriana (profilaxis de contactos).
https://guia-abe.es/temas-clinicos-meningitis-bacteriana-(profilaxis-de-contactos)
Tabla II. Vacunas meningocócicas en España: composición y pautas
Bibliografía
1. Pollard, Andrew J., Finn A. Neisseria meningitidis. In: Principles and Practice of Pediatric Infectious Diseases. 4th Edition. Elsevier; 2012. p. 730–41.
2. Álvarez García F. La adolescencia y la enfermedad meningocócica. Situación actual y nuevas vacunas. ADOLESCERE • Rev Form Contin la Soc Española Med la Adolesc. 2018;6(2):48–52.
3. Pizza M, Rappuoli R. Neisseria meningitidis: Pathogenesis and immunity. Curr Opin Microbiol. 2015;23:68–72.
4. Hill DJ, Griffiths NJ, Borodina E, Virji M. Cellular and molecular biology of Neisseria meningitidis colonization and invasive disease. Clin Sci. 2010;118(9):547–64.
5. Pace D, Pollard AJ. Meningococcal disease: Clinical presentation and sequelae. Vaccine. 2012 May 30;30(SUPPL. 2):B3–9.
6. Thompson MJ, Ninis N, Perera R, Mayon-White R, Phillips C, Bailey L, et al. Clinical recognition of meningococcal disease in children and adolescents. Lancet. 2006;367(9508):397–403.
7. Red Nacional de Vigilancia Epidemiológica. Enfermedad meningocócica vigilancia de la temporada 2017-2018 [acceso 15 de septiembre del 2019]. Disponible en: https://docplayer.es/116868940-Enfermedad-meningococica-vigilancia-de-la-temporada-resultados-de-la-red-nacional-de-vigilancia-epidemiologica.html.
8. Comité Asesor de Vacunas (CAV-AEP). Meningococo [Internet]. Manual de vacunas en línea de la AEP. 2019 [acceso 15 de septiembre del 2019]. Disponible en: https://vacunasaep.org/documentos/manual/cap-30.
9. Christensen H, May M, Bowen L, Hickman M, Trotter CL. Meningococcal carriage by age: A systematic review and meta-analysis. Lancet Infect Dis. 2010 Dec;10(12):853-61.
10. Pollard AJ, Frasch C. Development of natural immunity to Neisseria meningitidis. Vaccine. 2001;19(11–12):1327–46.
11. Grupo de trabajo vacunación frente a EMI de la Ponencia de Programa y Registro de Vacunaciones. Recomendaciones de vacunación frente a enfermedad meningocócica invasiva. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad, Consumo y Bienestar Social, marzo 2019.
12. Lingappa JR, Al-Rabeah AM, Hajjeh R, Mustafa T, Fatani A, Al-Bassam T, et al. Serogroup W-135 meningococcal disease during the Hajj, 2000. Emerg Infect Dis. 2003;9(6):665-671.
13. Campbell H, Edelstein M, Andrews N, Borrow R, Ramsay M, Ladhani S. Emergency meningococcal ACWY vaccination program for teenagers to control group W meningococcal disease, England, 2015–2016. Emerg Infect Dis. 2017 Jul;23(7):1184–7.
14. Rouphael NG, Stephens DS. Neisseria meningitidis: Biology, microbiology, and epidemiology. Methods in Molecular Biology. 2012;799:1-20.
15. Toneatto D, Pizza M, Masignani V, Rappuoli R. Emerging experience with meningococcal serogroup B protein vaccines. Expert Rev Vaccines. 2017 May;16(5):433-451.
16. Gandhi A, Balmer P, York LJ. Characteristics of a new meningococcal serogroup B vaccine, bivalent rLP2086 (MenB-FHbp; Trumenba®). Postgrad Med. 2016 Aug 17;128(6):548–56.
17. Rappuoli R, Pizza M, Masignani V, Vadivelu K. Meningococcal B vaccine (4CMenB): the journey from research to real world experience. Expert Rev Vaccines. 2018;17(12):1111–21.
18. Nadel S, Ninis N. Invasive meningococcal disease in the vaccine era. Front Pediatr. 2018;6:321.
19. McMullan BJ, Andresen D, Blyth CC, Avent ML, Bowen AC, Britton PN, et al. Antibiotic duration and timing of the switch from intravenous to oral route for bacterial infections in children: systematic review and guidelines. Lancet Infect Dis. 2016;16(8):e139–52.
20. Joint Committee on Vaccination and Immunisation (JCVI). Draft Meeting minutes. Minute of the meeting on 03 October 2018. [Internet]. 2018 [acceso 15 de septiembre del 2019]. p. 1–17. Available from: https://www.gov.uk/government/groups/joint-committee-on-vaccination-and-immunisation.
21. Moreno-Pérez D, Álvarez García FJ, Álvarez Aldeán J, Cilleruelo Ortega MJ, Garcés Sánchez M, García Sánchez N, et al. Calendario de vacunaciones de la Asociación Española de Pediatría: recomendaciones 2019. An Pediatría. 2019;90(1):56.e1-56.e9.
22. Tipton M, Daly W, Senders S, Block SL, Lattanzi M, Mzolo T, et al. MenACWY-CRM conjugate vaccine booster dose given 4-6 years after priming: Results from a phase IIIb, multicenter, open label study in adolescents and adults. Vaccine. 2019 Sep 30;37(42):6171-6179.
23. Nolan T, Santolaya ME, de Looze F, Marshall H, Richmond P, Henein S, et al. Antibody persistence and booster response in adolescents and young adults 4 and 7.5 years after immunization with 4CMenB vaccine. Vaccine. 2019 Feb 21;37(9):1209–18.